


 علم الكيمياء
علم الكيمياء 
 الكيمياء التحليلية
الكيمياء التحليلية 
 الكيمياء الحياتية
الكيمياء الحياتية 
 الكيمياء العضوية
الكيمياء العضوية 
 الكيمياء الفيزيائية
الكيمياء الفيزيائية
 الكيمياء اللاعضوية
الكيمياء اللاعضوية 
 مواضيع اخرى في الكيمياء
مواضيع اخرى في الكيمياء
 الكيمياء الصناعية
الكيمياء الصناعية |
أقرأ أيضاً
التاريخ: 6-1-2022
التاريخ: 2023-07-10
التاريخ: 29-11-2019
التاريخ: 10-7-2018
|
نقطة الانصهار Melting point
نجد في الأجسام الصلبة المتبلورة أن الجسيمات التي تتصرف كوحدات بناء – أيونات أو جزيئات – رتبت بطريقة متناظرة ومنتظمة جداً؛ وأن هناك نمطاً هندسياً يتكرر مرات ومرات ضمن البلورة.
والانصهار هو التحول من ترتيب عالي الانتظام للجسيمات في الشبكة البلورية، الى ترتيب أكثر عشوائية يسير السوائل (انظر الشكلين 1.1 و2.1). يحدث الانصهار عند الوصول الى درجة حرارة تكون عندها الطاقة الحرارية للجسيمات كبيرة وتكفي للتغلب على القوى البلورية الداخلية التي تثبتها في أماكنها. يشكل المركب الأيوني، بلورات تكون فيها وحدات البناء، أيونات كلوريد الصوديوم الصلب، مثلاً، يتكون من أيونات صوديوم موجبة وأيونات كلوريد سالبة، تتناوب بطريقة شديدة الانتظام. وبحيط بكل أيون موجب ستة أيونات سالبة متساوية البعد عنه: واحد في كل جانب من الجوانب الأربعة، واحد أمامه، وآخر خلفه.

الشكل 18.1: انصهار بلورة أيونية. الواحدات أيونات
كذلك يكون كل أيون سالب محاط بنفس الأسلوب، بستة أيونات موجبة. لا يوجد شيء هنا تستطيع تسميته، بشكل مناسب، جزيء كلوريد الصوديوم. فليس هناك أي أيون صوديوم معين ينتمي الى أي أيون كلور بذاته فهو ينجذب بالتساوي الى ست أيونات كلوريد. إن البلورة قوية للغاية، بنيتها صلبة، لأن القوى الكهرساكنة التي تثبت كل أيون في موقعه هائلة. يمكن التغلب على هذه القوى الأيونية الداخلية، فقط في درجة حرارة عالية جداً؛ إذ أن نقطة انصهار كلوريد الصوديوم هي 801˚س.
تشبه بلورات المركبات الأيونية الأخرى بلورات كلوريد الصوديوم من حيث أن لها شبكة أيونية بالرغم من أن الترتيب الهندسي الدقيق الدقيق لها، قد يختلف. ونتيجة لذلك، فإن هذه المركبات الأيونية الأخرى لها نقاط انصهار عالية أيضاً. وهناك العديد من الجزيئات التي تحتوي روابط أيونية وروابط مشتركة معاً. فمثلاً، يتألف نترات البوتاسيوم KNO3، من أيونات بوتاسيوم موجبة K+، وأيونات نترات سالبة NO3؛ ويرتبط النتروجين مع الاكسجين في أيون النترات NO3-، بروابط مشتركة. وتتعين الخواص الفيزيائية لمركبات كهذا المركب، بالروابط الأيونية الى حد كبير، وهكذا تملك نترات البوتاسيوم خواصاً فيزيائية مشابهة جداً لتلك التي يملكها كلوريد الصوديوم.
يشكل المركب غير الأيوني، أي المركب الذي ترتبط ذراته بعضها مع بعض كلياً بروابط مشتركة، بلورات تكون فيها وحدات البناء هي الجزيئات. يجب التغلب على تلك القوى التي تربط جزيئات المركب بعضها مع بعض لإحداث الانصهار. وبشكل عام، تكون هذه القوى بين الجزيئية intermolecular ضعيفة جداً بالمقارنة مع القوى التي تربط الأيونات. وهكذا يجب لصهر كلوريد الصوديوم تقديم طاقة كافية لتحطيم الرابطة الأيونية بين Na+ وCl-. أما لصهر الميتان CH4، فإنه لا يلزم تقديم طاقة لتحطيم الروابط المشتركة بين الكربون والهيدروجين، بل يلزم فقط تقديم طاقة كافية، لفصل جزيئات الميتان CH4 بعضها عن بعض. ولذلك على عكس كلوريد الصوديوم، فإن الميتان ينصهر في الدرجة (-183˚س).
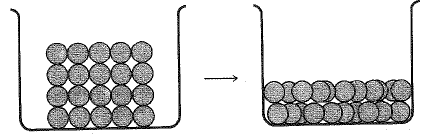
الشكل 2.1: انصهار بلورة غير أيونية. الوحدات جزيئات.



|
|
|
|
إدارة الغذاء والدواء الأميركية تقرّ عقارا جديدا للألزهايمر
|
|
|
|
|
|
|
شراء وقود الطائرات المستدام.. "الدفع" من جيب المسافر
|
|
|
|
|
|
|
ضمن مؤتمر الإمام الحجة(عجل الله فرجه) العلمي باحث كويتي يناقش إثبات ولادة الإمام المهدي (عجّل الله فرجه) من التّوقيعات الشّريفة
|
|
|