


 النبات
النبات
 الحيوان
الحيوان
 الأحياء المجهرية
الأحياء المجهرية
 علم الأمراض
علم الأمراض
 التقانة الإحيائية
التقانة الإحيائية
 التقنية الحيوية المكروبية
التقنية الحيوية المكروبية
 التقنية الحياتية النانوية
التقنية الحياتية النانوية
 علم الأجنة
علم الأجنة
 الأحياء الجزيئي
الأحياء الجزيئي
 علم وظائف الأعضاء
علم وظائف الأعضاء
 الغدد
الغدد
 المضادات الحيوية
المضادات الحيوية|
Read More
Date: 9-5-2016
Date: 27-12-2015
Date: 15-12-2015
|
Elongation Factors (EFs(
Elongation of the nascent polypeptide chain during translation of protein biosynthesis requires three elongation factors (EF-Tu, EF-Ts, and EF-G) in prokaryotes and requires four factors, (EF-1 a, EF-1 b, EF-1 g and EF-2) in eukaryotes (Table 1). The basic function of these elongation factors is to recycle the delivery of aminoacyl-transfer RNA molecules to the A site of the ribosome and to translocate the ribosome one codon forward after the peptidyl transfer reaction. Because of this common scenario, elongation factors share high functional and structural similarities in prokaryotes and eukaryotes: EF-Tu is equivalent to EF-1 a, EF-Ts to EF-1 bg, and EF-G to EF-2 (1).
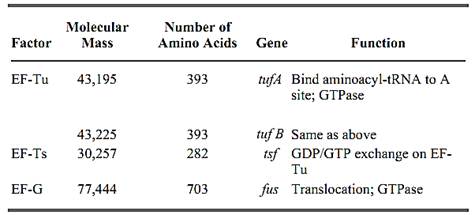
Table 1. Escherichia coli Elongation Factors
The polypeptide elongation cycle can be divided into three steps: (i) delivery of aminoacyl-tRNA to the ribosome, (ii) peptidyl transfer, and (iii) translocation of the ribosome (Fig. 1). Aminoacyl-tRNA first forms a ternary complex with EF-Tu (EF-1 a) and GTP. EF-Tu is one of the most abundant proteins. In Escherichia coli, it comprises about 5% of the soluble protein, and the EF-Tu/ribosome ratio is up to 7:1 in rapidly growing cells. The aminoacyl-tRNA:EF-Tu:GTP ternary complex binds to the A site of the ribosome. The proper binding of EF-Tu to the ribosome and the correct base-pairing between codon and the anticodon of the tRNA trigger hydrolysis of EF-Tu-bound GTP to GDP through activation by the GTPase active center on the ribosome. Note that both EF-Tu and EF-G carry conserved G-domains for binding guanine nucleotides, but they need the common GTPase center for stimulating the hydrolysis of GTP (ribosome-dependent GTPase). Once GTP is hydrolyzed, the GDP form of EF-Tu no longer remains bound to the ribosome because of protein conformation is altered. Common to the functioning of G-proteins is that activation occurs by binding GTP, while deactivation is achieved by GTP hydrolysis. GTP and GDP act as allosteric effectors on their target proteins, thus altering the conformation.
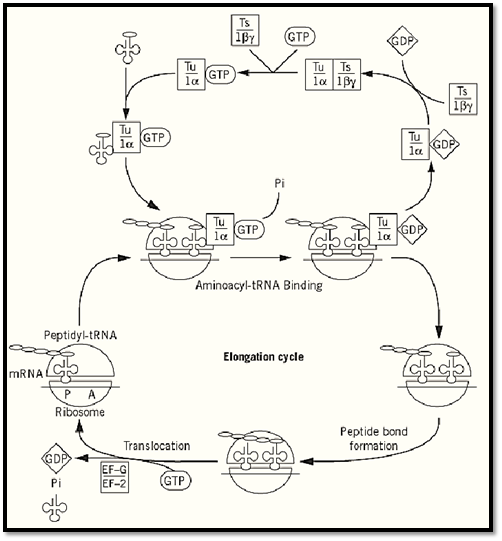
Figure 1. Elongation pathway of protein synthesis. Prokaryotic (upper) and eukaryotic (lower) elongation factors are represented in boxes.
EF-Tu alone is very unstable, but is readily stabilized by GTP, GDP, or EF-Ts. EF-Ts (EF-1bg) is involved in the guanine nucleotide exchange of aEF-Tu (EF-1a). EF-Ts catalyzes conversion of the EF-Tu:GDP complex to EF-Tu:GTP, promoting the recycling EF-Tu for new ternary-complex formation.
After peptidyl transfer, the elongated peptidyl-tRNA is bound to the A site of the ribosome while the deacylated tRNA is bound to the P site. EF-G (EF-2) is a translocase protein that forwards peptidyl-tRNA from the A site to the P site on the ribosome and forwards the deacylated tRNA from the P site to the E site. The GTP form of EF-G is the active state and binds to the ribosome. Translocation of the ribosome is coordinated with the hydrolysis of GTP bound to EF-G. Presumably, GTP hydrolysis induces conformational constraints on the ribosome that lead to the movement of the ribosome. Then, the GDP form of EF-G dissociates from the ribosome.
EF-3 appears to be a unique translation factor that is found only in yeast and fungi (2). Together with yeast or mammalian EF-1a and EF-2, it is required for protein synthesis with ribosomes, except for mammalian ribosomes. This has prompted the suggestion that a corresponding activity in higher eukaryotes may be part of the ribosome; alternatively, EF-3 may be unique to yeast and fungi. EF-3 is known to promote the ejection of deacylated tRNA from the E site of the ribosome following translocation in vitro, thereby enhancing the binding of an aminoacyl-tRNA to the A site.
The three-dimensional (3D) structure of Thermus thermophilus EF-G comprises six subdomains, G, G′, and II–V (Fig. 2, left). The C-terminal part, domains III–IV, appears to mimic the shape of tRNA (3-6). The 3D structure of the ternary complex of Phe-tRNA, Thermus aquaticus elongation factor EF-Tu, and the nonhydrolyzable GTP analog, GDPNP, is almost completely superimposable with EF-G:GDP [Fig. 2, right (5)], showing that domains III, IV, and V appear to mimic the shapes of the acceptor stem, anticodon helix, and T stem of tRNA in the ternary complex, respectively. Domain IV of EF-G forms a protruding “rod” conformation, which is similar to the shape of the anticodon arm of tRNA. These findings strongly suggest a common requirement for the structure and function on the ribosome. This resemblance of part of EF-G and tRNA represents a novel concept of “molecular mimicry between nucleic acid and protein.”
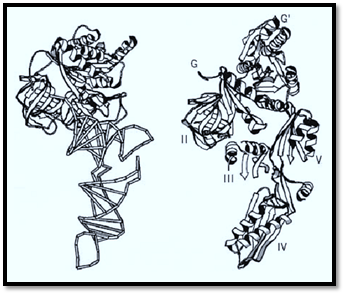
Figure 2. The structures of elongation factor EF-G:GDP (right) and EF-Tu:GDPNP:Phe-tRNAPhe (left). Domain II in EF-G and domain II in EF-Tu were placed in identical orientations, and the structures are shown side by side in a schematic representation to the same scale.(Reproduced from the diagram kindly generated by A. Ævarsson and A. Liljas.)
References
1.W. C. Merrick and J. W. B. Hershey (1996) In Translational Control (J. W. B. Hershey, M. B. Mathews, and N. Sonenberg, eds.), Cold Spring Harbor Press, Cold Spring Harbor, NY, pp. 31–69.
2. G. P. Belfield and M. F. Tuite (1993) Mol. Microbiol. 9, 411–418.
3. A. Ævarsson et al. (1994) EMBO J. 13, 3669–3677.
4. J. Czworkowski, J. Wang, T. A. Steitz, and P. B. Moore (1994) EMBO J. 13, 3661–3668.
5. P. Nissen et al. (1995) Science 270, 1464–1472.
6. K. Ito, K. Ebihara, M. Uno, and Y. Nakamura (1996) Proc. Natl. Acad. Sci. USA 93, 5443–5448.

|
|
|
|
إجراء أول اختبار لدواء "ثوري" يتصدى لعدة أنواع من السرطان
|
|
|
|
|
|
|
دراسة تكشف "سببا غريبا" يعيق نمو الطيور
|
|
|
|
|
|
لأعضاء مدوّنة الكفيل السيد الصافي يؤكّد على تفعيل القصة والرواية المجسّدة للمبادئ الإسلامية والموجدة لحلول المشاكل المجتمعية
|
|
|
|
قسم الشؤون الفكرية يناقش سبل تعزيز التعاون المشترك مع المؤسّسات الأكاديمية في نيجيريا
|
|
|
|
ضمن برنامج عُرفاء المنصّة قسم التطوير يقيم ورشة في (فنّ الٕالقاء) لمنتسبي العتبة العباسية
|
|
|
|
وفد نيجيري يُشيد بمشروع المجمع العلمي لحفظ القرآن الكريم
|