


 علم الكيمياء
علم الكيمياء 
 الكيمياء التحليلية
الكيمياء التحليلية 
 الكيمياء الحياتية
الكيمياء الحياتية 
 الكيمياء العضوية
الكيمياء العضوية 
 الكيمياء الفيزيائية
الكيمياء الفيزيائية
 الكيمياء اللاعضوية
الكيمياء اللاعضوية 
 مواضيع اخرى في الكيمياء
مواضيع اخرى في الكيمياء
 الكيمياء الصناعية
الكيمياء الصناعية |
أقرأ أيضاً
التاريخ: 2024-02-07
التاريخ: 18-4-2017
التاريخ: 2023-09-18
التاريخ: 25-4-2017
|
إن معظم أيونات المعادن بإمكانها استقبال زوج من الإلكترونات من أيون آخر، أو من جزيء به ذرة عليها إلكترونات حرة فتنشأ رابطة تساهمية من طرف واحد (Coordinate covalent bond). والأيون أو الجزيء الذي يحتوي على ذرة تعطي زوج الإلكترونات تسمى المعطي (Ligand) ، والمركب الناتج يسمى المعقد (Complex)، ويمكن تشبيه الإلكترونات المنبثقة من المعطي بالسن، ويكون المعطي أحادي السن إذا ساهم بزوج واحد من الإلكترونات (mono dentate) ، وإذا ساهم بزوجين فيسمى (bidentate)، وهكذا إذا كانت أزواج الإلكترونات المشتركة كثيرة
فيسمى (Polydentate ligand).
وكمثال على تكون المعقدات يُعَدُّ الماء معطياً ممتازاً، ويتفاعل ليكون أيوناً مائياً، فمثلاً أيون النحاس يتفاعل مع أربعة جزيئات من الماء كما يلي:

ويسمى عدد الجزيئات المعطية التي تتحد مع أيون المعدن بالعدد التساهمي. وعلى هذا فأيون النحاس عدده التساهمي 4 إذ إنه يتحد مع أربعة جزيئات ماء، وجزيء الماء هذا يُعَدُّ معطياً أحادي السن مثله مثل جزيء الأمونيا. NH3 وهناك أيونات أيضاً تُعَدُّ أحادية السن مثل - CN-، F- ، Cl- ، OH ، والمعطيات ثنائية السن
مثل -NH2 CH2 CH2NH2 ويسمى إيثيلين ثنائي الأمين (Ethylene diamine) ومن أشهر هذه (ethylenediamine tetra acetic acid) (EDTA) .
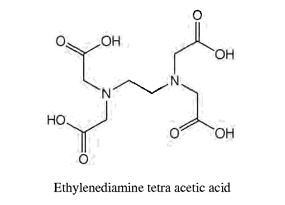



|
|
|
|
تفوقت في الاختبار على الجميع.. فاكهة "خارقة" في عالم التغذية
|
|
|
|
|
|
|
أمين عام أوبك: النفط الخام والغاز الطبيعي "هبة من الله"
|
|
|
|
|
|
|
قسم شؤون المعارف ينظم دورة عن آليات عمل الفهارس الفنية للموسوعات والكتب لملاكاته
|
|
|