


 علم الكيمياء
علم الكيمياء 
 الكيمياء التحليلية
الكيمياء التحليلية 
 الكيمياء الحياتية
الكيمياء الحياتية 
 الكيمياء العضوية
الكيمياء العضوية 
 الكيمياء الفيزيائية
الكيمياء الفيزيائية
 الكيمياء اللاعضوية
الكيمياء اللاعضوية 
 مواضيع اخرى في الكيمياء
مواضيع اخرى في الكيمياء
 الكيمياء الصناعية
الكيمياء الصناعية | Molecular shape and the VSEPR model Valence-shell electron-pair repulsion theory |
|
|
|
Read More
Date: 18-2-2016
Date: 8-3-2016
Date: 30-5-2016
|
Molecular shape and the VSEPR model Valence-shell electron-pair repulsion theory
The shapes of molecules containing a central p-block atom tend to be controlled by the number of electrons in the valence shell of the central atom. The valence-shell electron-pair repulsion (VSEPR) theory provides a simple model for predicting the shapes of such species. The model combines original ideas of Sidgwick and Powell with extensions developed by Nyholm and Gillespie, and may be summarized as follows:
The VSEPR theory works best for simple halides of the pblock elements, but may also be applied to species with other substituents. However, the model does not take steric factors (i.e. the relative sizes of substituents) into account. In a molecule EXn, there is a minimum energy arrangement for a given number of electron pairs. In BeCl2 (Be, group 2), repulsions between the two pairs of electrons in the valence shell of Be are minimized if the Cl_Be_Cl unit is linear. In BCl3 (B, group 13), electron–electron repulsions are minimized if a trigonal planar arrangement of electron pairs (and thus Cl atoms) is adopted. The structures in the lefthand column of Figure 1.1 represent the minimum energy structures for EXn molecules for n = 2–8 and in which there are no lone pairs of electrons associated with E. Table 1.1 gives further representations of these structures, along with their ideal bond angles. Ideal bond angles may be expected


Fig. 1.1 (a) A simplified orbital interaction diagram for CO which allows for the effects of some orbital mixing. The labels 1σ, 2σ . . . rather than σ(2s) . . . are used because some orbitals contain both s and p character. (b) A more rigorous (but still qualitative) orbital interaction diagram for CO.


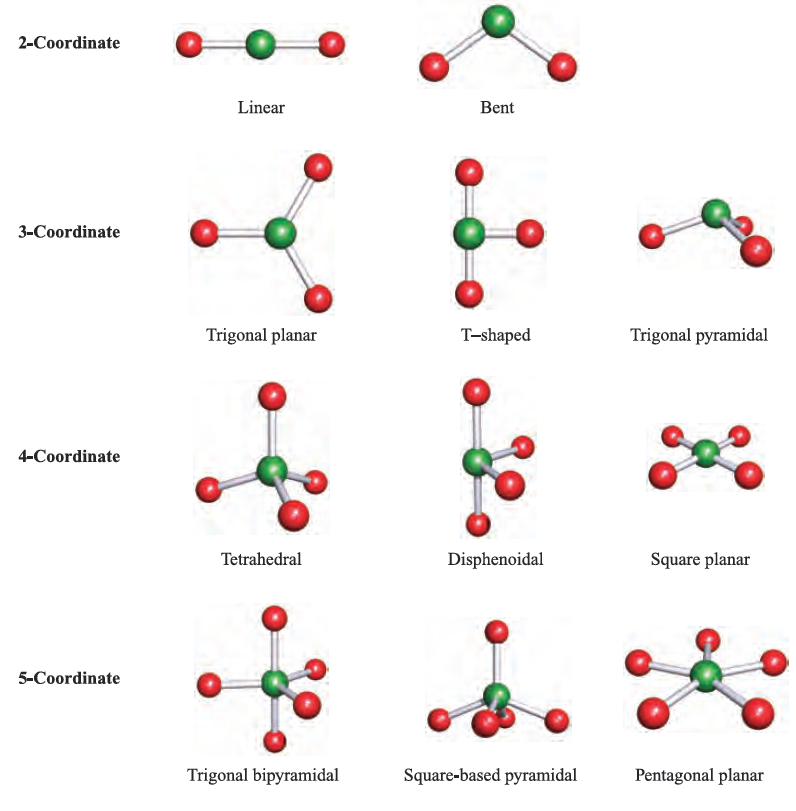
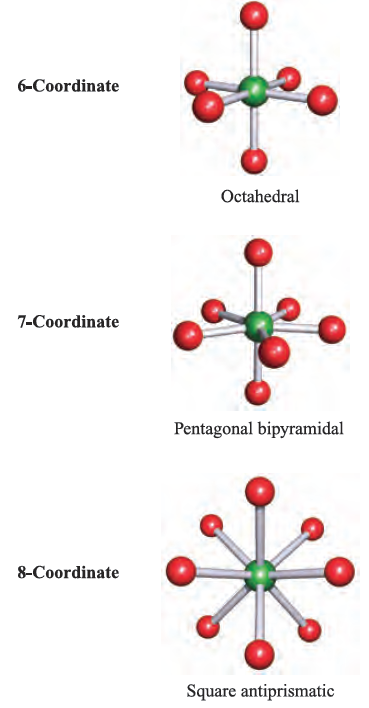
Table 1.1 ‘Parent’ shapes for EXn molecules (n = 2–8).


when all the X substituents are identical, but in, for example, BF2Cl (1.18) some distortion occurs because Cl is larger than F, and the shape is only approximately trigonal planar.


The presence of lone pairs is taken into account using the guidelines above and the ‘parent structures’ in Figure 1.29.
In H2O (1.19), repulsions between the two bonding pairs and two lone pairs of electrons lead to a tetrahedral arrangement but owing to the inequalities between the lone pair–lone pair, lone pair–bonding pair and bonding pair– bonding pair interactions, distortion from an ideal arrangement arises and this is consistent with the observed H_O_H bond angle of 104.58.e



|
|
|
|
الصين.. طريقة لمنع تطور قصر النظر لدى تلاميذ المدارس
|
|
|
|
|
|
|
ماذا سيحدث خلال كسوف الشمس يوم السبت؟
|
|
|
|
|
|
|
قسم الشؤون الدينية يختتم محاضراته الرمضانية في صحن مرقد أبي الفضل العباس (عليه السلام)
|
|
|