


 النبات
النبات
 الحيوان
الحيوان
 الأحياء المجهرية
الأحياء المجهرية
 علم الأمراض
علم الأمراض
 التقانة الإحيائية
التقانة الإحيائية
 التقنية الحيوية المكروبية
التقنية الحيوية المكروبية
 التقنية الحياتية النانوية
التقنية الحياتية النانوية
 علم الأجنة
علم الأجنة
 الأحياء الجزيئي
الأحياء الجزيئي
 علم وظائف الأعضاء
علم وظائف الأعضاء
 الغدد
الغدد
 المضادات الحيوية
المضادات الحيوية|
Read More
Date: 20-5-2021
Date: 11-3-2021
Date: 9-12-2020
|
Alpha-Helix Formation
a-Helices are the most common type of secondary structure in globular proteins. As such, there is intense interest in understanding the factors that contribute to a-helix formation in peptides and proteins (1-4).
All peptide helices unfold with increasing temperature. This indicates that helix formation is an enthalpically favorable process (it proceeds with the release of heat). The main feature of helical structure is the repeating pattern of intramolecular hydrogen bonds formed between atoms in the peptide backbone (> C=O · H N <). These hydrogen bonds probably provide the main enthalpic stabilization to the helical conformation (5). Opposing this enthalpy is the conformational entropy of freezing the backbone conformation, because the process of change from a disordered conformation (unfolded peptide or protein) to an ordered one (helix) is unfavorable entropically. This unfavorable entropy is about the same magnitude as the favorable enthalpy; that is, in isolation the helices are at best marginally stable.
Because the a-helix has an (i, i + 4) backbone hydrogen bonding pattern, the first four > N H and the last four >C=O groups of the helix will not be hydrogen-bonded to a backbone partner. Polar groups that do not form hydrogen bonds to water or other protein groups are destabilizing (see Protein Stability). Therefore it is important that these groups either be hydrated or have other intramolecular partners. The side chain of the first residue of the helix (the “N-cap”) often fills this role, if it is able to hydrogen-bond to one or two otherwise unsatisfied backbone >N H groups. These “capping” hydrogen bonds have been proposed to be important factors in determining where helices begin and end in proteins (6, 7).
The helical conformation has the peptide groups and their associated dipoles aligned in the same direction, whereas in nonhelical forms the dipoles are distributed randomly. As the helix forms, the dipoles on adjacent peptide groups align in an unfavorable fashion (see Electrostatic Interactions).
However, when a full turn of the helix is completed, the first hydrogen bond is formed and the peptide groups involved in the hydrogen bond align favorably. This adds to the cooperativity of helix formation: Once the first hydrogen bond is formed, it is easier to continue forming the helix. The alignment of the individual peptide group dipoles in a single direction gives rise to a helix macrodipole (simply the additive effects of the individual dipoles). The N-terminus of the helix has a partial positive charge, while the C-terminus carries a partial negative charge. Residues with charged side chains at the ends of a helix can interact favorably or unfavorably with the helix macrodipole, giving rise to an effect known as the charge–dipole interaction.
Different amino acid residues have different tendencies to form helices. For example, alanine is found in protein helices much more often than is glycine (8). The intrinsic preference to be in a helical conformation has been termed helix propensity. Since this is an intrinsic property, it should be characteristic of a given amino acid and independent of context. However, quantitative measurements of helix propensity in different systems have provided markedly different results (1, 2, 4). This reflects the difficulty of measuring intrinsic properties in complex molecules like proteins and peptides (however, see Ref. 9).
Interactions between side chains can also affect the stability of helices. Side chains three and four residues away from each other in the amino acid sequence will be close in space in a helical conformation. Therefore, electrostatic interactions, hydrogen bonds, or hydrophobic contacts between these side chains can contribute to helix stability. Likewise, if interactions are possible in the nonhelical form of the peptide or protein, this can alter the amount of a-helix observed in a peptide or protein. Figure 1 shows examples of various types of side-chain interactions possible in the helix, an estimate of the magnitudes of the contributions of the main factors contributing to helix stability, and comparison of these estimates with the free energy provided by typical interactions in proteins.
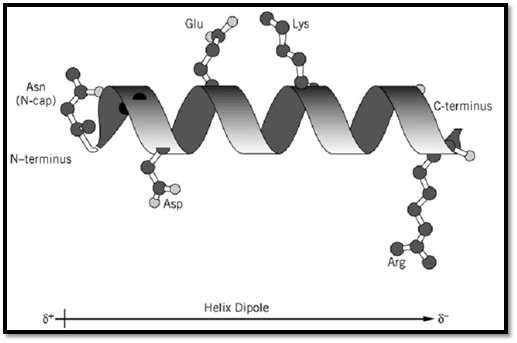
Figure 1. Interactions involving amino acid side chains that affect the stability of isolated a-helices. (Top) Ribbon model of an a-helix, with stabilizing interactions involving (i) hydrogen bonding of the N-cap side-chain at the N-terminus, indicated here as Asn, (ii) favorable electrostatic interactions of ionized side chains (Asp and Arg shown here) with the helix dipole, and (iii) electrostatic interactions between oppositely charged side chains on adjacent turns of the helix. (Bottom) Quantitative estimates of the net stabilizing interactions in an isolated a-helix and in folded globular proteins.
In addition to the stability of helices, their rates of folding and unfolding are of interest as well. The transition from helix to random coil occurs very rapidly, on the order of nanoseconds, two to three orders of magnitude faster than the fastest folding proteins (10).
References
1. J. M. Scholtz and R. L. Baldwin (1992) Annu. Rev. Biophys. Biomol. Struct. 21, 95–118.
2. A. Chakrabartty and R. L. Baldwin (1995) Adv. Protein Chem. 46, 141–176.
3. J. W. Bryson, S. F. Betz, H. S. Lu, D. J. Suich, H. X. Zhou, K. T. O''Neil, and W. F. DeGrado (1995) Science 270, 935–941.
4. N. R. Kallenbach, P. Lyu, and H. Zhou (1996) In Circular Dichroism and the Conformational Analysis of Biopolymers (G. D. Fasman, ed.), Plenum Press, New York.
5. J. M. Scholtz, S. Marqusee, R. L. Baldwin, E. J. York, J. M. Stewart, M. Santoro, and D. W. Bolen (1991) Proc. Natl. Acad. Sci. USA 88, 2854–2858.
6. L. G. Presta and G. D. Rose (1988) Science 240, 1632–1641.
7. E. T. Harper and G. D. Rose (1993) Biochemistry 32, 7605–7609.
8. P. Y. Chou and G. D. Fasman (1978) Adv. Enzymol. 47, 45–148.
9. J. K. Myers, C. N. Pace, and J. M. Scholtz (1997) Proc. Natl. Acad. Sci. USA 94, 2833–2837.
10. S. Williams, T. P. Causgrove, R. Gilmanshin, K. S. Fang, R. H. Callender, W. H. Woodruff, and R. B. Dyer (1996) Biochemistry 35, 691–697.

|
|
|
|
إجراء أول اختبار لدواء "ثوري" يتصدى لعدة أنواع من السرطان
|
|
|
|
|
|
|
دراسة تكشف "سببا غريبا" يعيق نمو الطيور
|
|
|
|
|
|
قسم الشؤون الفكرية يقيم برنامج (صنّاع المحتوى الهادف) لوفدٍ من محافظة ذي قار
|
|
|
|
الهيأة العليا لإحياء التراث تنظّم ورشة عن تحقيق المخطوطات الناقصة
|
|
|
|
قسم شؤون المعارف يقيم ندوة علمية حول دور الجنوب في حركة الجهاد ضد الإنكليز
|
|
|
|
وفد جامعة الكفيل يزور دار المسنين في النجف الأشرف
|