


 علم الكيمياء
علم الكيمياء 
 الكيمياء التحليلية
الكيمياء التحليلية 
 الكيمياء الحياتية
الكيمياء الحياتية 
 الكيمياء العضوية
الكيمياء العضوية 
 الكيمياء الفيزيائية
الكيمياء الفيزيائية
 الكيمياء اللاعضوية
الكيمياء اللاعضوية 
 مواضيع اخرى في الكيمياء
مواضيع اخرى في الكيمياء
 الكيمياء الصناعية
الكيمياء الصناعية |
أقرأ أيضاً
التاريخ: 2023-11-27
التاريخ: 7-5-2017
التاريخ: 25-4-2017
التاريخ: 2024-02-15
|
يمكن تمييز نقطة النهاية عند معايرة الحوامض والقواعد بتغيير الدليل عند نقطة التكافؤ ولكي نختار الدليل المناسب يجب تعيين مدى الـ pH عند نقطة التكافؤ ثم نختار الدليل الذي يتفق مداه مع مقدار هذا المدى. عند معايرة حامض قوي مع قاعدة قوية تكون المحلول بصورة عامة عند نقطة التكافؤ 7.0 وأن الملح المتكون لا يتحلل مائياً . ولمعرفة التغير في الـ pH المحلول في إثناء المعايرة يمكن رسم منحنــــي المعايرة أو التعادل .
ويمكن رسم منحني التعادل بطريقتين :
أولاً: منحني التعادل في الحالة الأولى
معايرة حامض قوي بقاعدة قوية ومعايرة قاعدة قوية بحامض قوي .
الجدول التالي يوضح معايرة حامض قوي HCI بإضافة قاعدة قوية NaOH
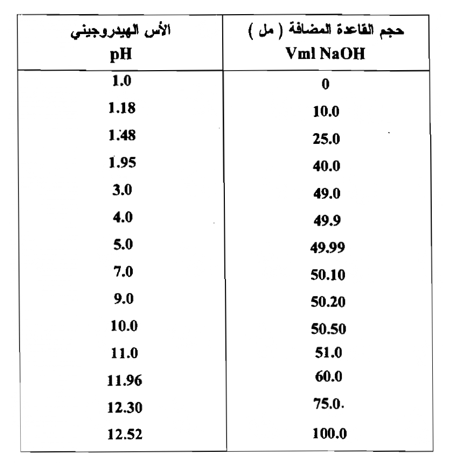
ونلاحظ من هذا الجدول أن التغير المفاجئ الذي يطرأ على الأس الهيدروجيني للمحلول بالقرب من نقطة التكافؤ فإضافة 0.02 ( أي من 49.99 إلي 50.01 ) يسبب زيادة الأس الهيدروجيني من 50 إلى 9.0 أي أن التركيز الجزيئي لأيونات الهيدروجين يقل بمقدار عشرة الآف ضعف بنتيجة إضافة 0.02 مل من القاعدة . ونستنتج كذلك أن من الممكن اختيار عدد من الدلائل يتغير لونها في هذا المدي . كما يتبين من الشكل (1) .

يلاحظ انه كلما قلت درجة تركيز الحامض والقاعدة كلما قلت قيمة التغير المفاجئ في الأس الهيدروجيني عند نقطة التكافؤ .
ويلاحظ من الشكل السابق أنه عندما تكون القوة العيارية للحامض والقاعدة 0.1 أو أكثر فإن مدي التغير في الأس الهيدروجيني عند نقطة التكافؤ يكون بين 4 - 10 وتغطي هذه المسافة مدي الدلائل مثل الفينونفثالين أو المثيل البرتقالي وبناء علي ذلك أياً منها يمكن أن يستخدم بنجاح في هذه الحالة ، أما إذا كانت القوة العيارية 0.001 أو أقل فإن الدليل المناسب هو البروموثيمول الأزرق فقط . وعند معايرة قاعدة بحامض قوي نحصل على منحنيات تعد الصورة المنعكسة في مرأة المنحنيات السابقة .
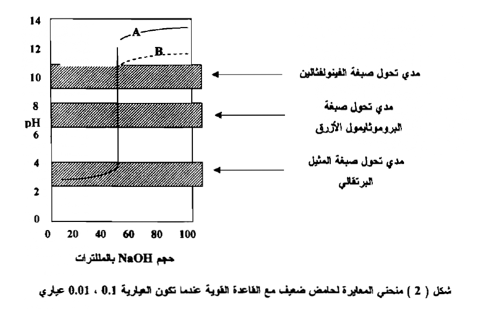
وبوضع قيم الـ pH على المحور الصادي وعدد المللترات من القاعدة علي المحور السيني يمكن رسم منحني التعادل لحامض ضعيف وهو حامض الخليك بوساطة قاعدة قوية وهي هيدروكسيد الصوديوم كما في الشكل (2) ويتضح منه أن كلا من الفينو لفثالين والبروموثيمول الأزرق يصلح لهذا التسحيح . أما المثيل البرتقالي فـــلا يصلح.
أمثلة محلولة
مثال (1) :
احسب الـ pH والـ pOH وتركيز أيون الهيدروكسيل لمحلول فيه التركيز 5 x 10-3 [H] =
الحل :

مثال (2) :
احسب POH ثم احسب تركيز ايون الهيدروجين وايون الهيدروكسيل لـPH يساوي 4.4 .
الحل :

مثال (3) :
احسب الـ pH والـ pOH لكل حالة مما يأتي :-
ا- محلول حامض الهيدروكلوريك 0.01 مولاري
ب - محلول حامض الخليك مولاري ودرجة ثانية - 0.135
ج محلول هيدروكسيد الصوديوم تركيزه مولاري 0.01
د محلول هيدروكسيد الألومونيوم تركيزه 0.01 مولاري وثانية بنسبة 0.115
الحل :
الحالة (أ)
حامض الهيدروكلوريك هو كامل الانحلال فيتأين في محلوله كلياً ويعطي 0.01 جرام - أيون .
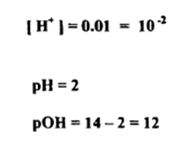
الحالة ( ب )
حامض الخليك حامض ضعيف التأين ، وبما أن محلول الحامض يتأين بنسبة 135 0 .
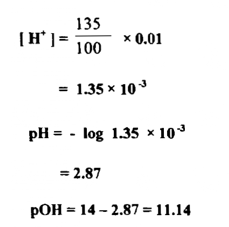
الحالة ( جـ )
هيدروكسيد الصوديوم قاعدة قوية تامة الانحلال ، تتأين في محلولها تأيناً كاملاً وتعطي 0.01 جرام - أيون الهيدروكسيل
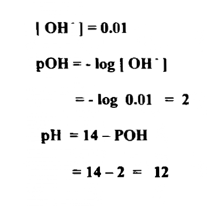
الحالة (د)
هيدروكسيد الالمنيوم قاعدة ضعيقة فتأينها ضعيف هي درجة الانحلال :




|
|
|
|
كيف تساهم الأطعمة فائقة المعالجة في تفاقم مرض يصيب الأمعاء؟
|
|
|
|
|
|
|
مشروع ضخم لإنتاج الهيدروجين الأخضر يواجه تأخيرًا جديدًا
|
|
|
|
|
|
|
أكثر من 5 آلاف وجبة يقدمها قسم المضيف يوميًّا لضيوف العراق من لبنان
|
|
|