


 علم الكيمياء
علم الكيمياء 
 الكيمياء التحليلية
الكيمياء التحليلية 
 الكيمياء الحياتية
الكيمياء الحياتية 
 الكيمياء العضوية
الكيمياء العضوية 
 الكيمياء الفيزيائية
الكيمياء الفيزيائية
 الكيمياء اللاعضوية
الكيمياء اللاعضوية 
 مواضيع اخرى في الكيمياء
مواضيع اخرى في الكيمياء
 الكيمياء الصناعية
الكيمياء الصناعية |
أقرأ أيضاً
التاريخ: 10-10-2016
التاريخ: 6-10-2016
التاريخ: 2024-01-25
التاريخ: 2024-06-20
|
معالجة المياه بالجير- صودا :
تميز استخدام الجير المطفأ ( الكلس المطفأ ) وكربونات الصوديوم لإزالة قساوة الماء بالأهمية منذ عهد طويل . ويستخدم الجير في العصر الحاضر بطريقتين : العمليات الباردة بالجير والعمليات الساخنة بالجير- صودا . تزال أيونات الكلسيوم من المياه على شكل CaCO3 وأيونات المغنيزيوم على شكل Mg(OH)2 وفيما يلي المعادلات النموذجية لهذه التفاعلات :
قساوة الكربونات :
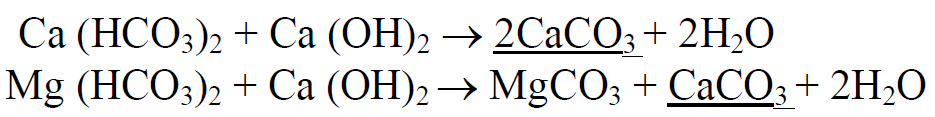
وبما أن MgCO3 شديد الانحلال لذلك تعتبر متابعة إضافة الجير ضرورية فتسبب ترسب ماءات المغنيزيوم حسب التفاعل :
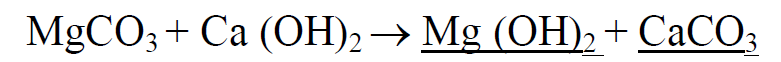
ومن أجل أملاح الكلسيوم والمغنيزيوم غير الكربوناتية المنحلة
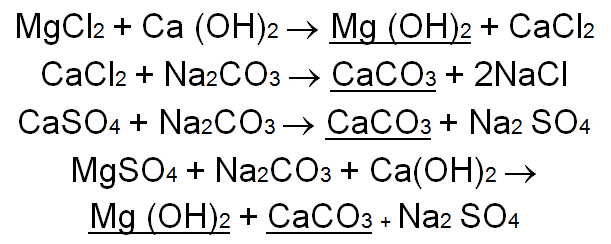
يبدو من هذه التفاعلات ، فيما يخص قساوة الكربونات ان كل مول ( جزئ) Mole من بيكربونات الكلسيوم يحتاج الى مول واحد من الجير ، بينما يحتاج كل مول من بيكربونات المغنيزيوم الى 2 مول من الجير . وفيما يخص القساوة اللاكربوناتية ايضا تحتاج املاح المغنيزيوم الى مزيد من مواد المعالجة ( مولا من كربونات الصوديوم واخر من الجير ) .
تم حساب الكميات التالية من المواد لإزالة ppm١00 من القساوة الموجودة في 1000 م3 من الماء :
قساوة بيكربونات الكلسيوم ( معبرا عنها كـ CaCO3 ) 62.4 كغ من الجبر. قساوة بيكربونات المغنيزيوم ( معبرا عنها كـ CaCO3 ) 124.7 كغ من الجير.
قساوة الكلسيوم اللاكربوناتي ( معبرا عنها كـ CaCO3 ) 103.1 كغ من كربونات الصوديوم . قساوة المغنيزيوم اللاكربوناتي ( معبرا عنها كـ CaCO3 ) 105.6كغ من كربونات الصوديوم و 62.4 من الجير .
تستخدم المعالجة البار ة بالجير بصورة رئيسية للتيسير الجزئي وتستخدم عادة جيرا رخيصا للتفاعل . ويمكن للجير في هذه الحالة أن يخفض قساوة الكلسيوم إلى ppm 35 إذا أتيحت الفرصة المناسبة للترسب . وبمكن تطبيق هذه الطريقة في التيسير الجزئي لمياه الصرف الصحي ( الصورتان 3 - 4 و 3 - 5 ) ، ولتهيئة مياه التبريد ، ولمعالجة بعض أنواع المياه في مصانع الورق عندما تسبب قساوة بيكربونات الكالسيوم بعض المشاكل . ويمكن إزالة قساوة كربونات المغنيزيوم اقتصاديا إلى أي مقدار مطلوب ، ولإزالتها نهائيا يجب إضافة أيونات الهيدروكسيل لتثبيط ذوبانية هيدروكسيد المغنيزيوم . ولتحفيز المعالجة تضاف عادة مادة مخثرة ، ككبريتات الألومنيوم أو كبريتات الحديد ، لتخفيض حمل الجسيمات المعلقة ولإنقاص الرواسب من الصبيب المفرط الإشباع إلى أدنى درجة . ولقد حلت اليوم الالكتروليتات ( الكهروليتات ) العضوية Electrolytes Poly Organic محل كثير من مواد التخثير اللاعضوية التقليدية ، لأن مواد التخثير اللاعضوية قد تؤدي إلى الاحتفاظ بالحديد والألومنيوم اللذان يسببان بعض المشاكل في تيارات الماء .
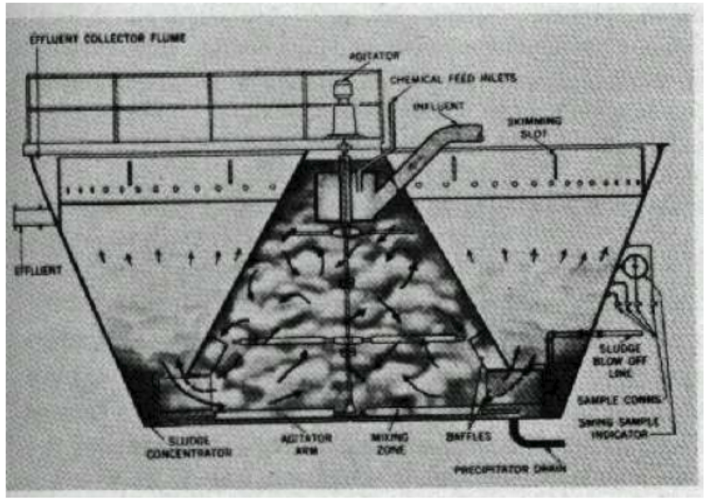
الصورة 3-4 رسم لجهاز ترسيب يظهر تشكل الرسابة والترشيح الصاعد عبر الدثار الكدر .
هناك طريقة ناجحة للتخفيف من فرط الإشباع هي طريقة التلامس مع كداره ( طمي) مترسبة مسبقا ( الصورة 3 - 5 ) .
فعندما تتعرض هذه المادة للمياه الخام والمواد الكيميائية ، تعمل السطوح المتشابهة أو " نوى البلورات أو البذور" على تسريع الترسيب . فيتم تسريع التفاعل ويكتمل على نحو أفضل ، لأن الجزيئات

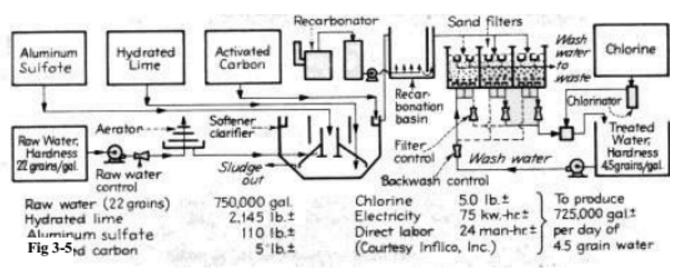
الصورة 3-5 مخطط جريان معالجة المياه البلدية .
تستقر بسهولة وبحجم أكبر في الراسب المتشكل حديثا . وتدعى المعدات التي طورت لإحداث هذا التلامس بـ المسرع Accelerator . يتألف مرسب سبولدنغ برموتيت Spaulding Permutit من حجيرتين ، إحداهما لمزج وتحريك المياه الخام مع مواد التيسير الكيميائية ومع الكدارة المتشكلة مسبقا ، والأخرى لترويق وترشيح المياه الميسرة عند مرورها صعودا عبر دثار الكدارة المعلق . تعمل آلات هذه النماذج على خفض زمن الترسيب من أربع ساعات إلى أقل من ساعة واحدة وتسبب عادة وفرآ في المواد الكيميائية المستخدمة .
إن أكثر مشاكل المعالجة الباردة بالجير- صودا هو الحجم الكبير للكدارة المتشكلة . وقد ثبت أن التخلص منها شاق ومكلف . يستخدم سبايركتور البرموتيت Spiractor Permutit في الترسيب المحفز ، الآمر الذي يقلل من حجم ومحتوى الكدارة الثمالية في الماء ، بحيث يكون الحجم الناتج حوالي 12 % من حجمه في العمليات التقليدية ، والنفاية الناتجة مماثلة للرمل الرطب .
تستخدم المعالجة الحارة بالجير- صودا بصورة كلية تقريبا لتهيئة مياه التغذية للمراجل . وبما أن هذه المعالجة تنجز عند درجة غليان الماء فإن التفاعلات تحدث بسرعة ويكون التخثير والتربيب أسهل وتطر كل الغازات المنحلة .
تتألف المعالجة الحارة بالجير- صودا من المراحل التالية.
- تسخين المياه الخام بواسطة البخار المنفلت .
- مزج الجير وكربونات الصوديوم وتوزيعه بالتساوي وفقآ لتحليل المياه الخام .
- ضخ محلول الجير والصودا .
- تفاعل الجير والصودا الذي يسهله التسخين المسبق أو بدونه .
- تخثير أو تحرير " فوق الإشباع " بمختلف الطرق ، كالتحريك البطيء أو التلامس مع " نوى التبلور" عن طريق تدوير الكدارة .
- الترويق أو إزالة الرواسب بالترشيح أو بدونه .
- ضخ المياه الميسرة .
- اجتراف الكدارة من قاع الخزان المخروطي ( ومن مرشحات التصفية ) .
إذا أنجزت التفاعلات الكيميائية المشتركة على نحو كامل فسوف تختزل قساوة المياه إلى معدل الانحلال النظري لكربونات الكلسيوم وهيدروكسيد المغنيزيوم وبهذا تبقى قساوة تقارب ppm 25 - 20 في المياه النقية ، وأقل قليلا من هذا الرقم عند قيمة 10-11 PH= التي تتضمنها المعالجة بالجير- صودا .



|
|
|
|
كل ما تود معرفته عن أهم فيتامين لسلامة الدماغ والأعصاب
|
|
|
|
|
|
|
ماذا سيحصل للأرض إذا تغير شكل نواتها؟
|
|
|
|
|
|
|
جامعة الكفيل تناقش تحضيراتها لإطلاق مؤتمرها العلمي الدولي السادس
|
|
|