


 علم الكيمياء
علم الكيمياء 
 الكيمياء التحليلية
الكيمياء التحليلية 
 الكيمياء الحياتية
الكيمياء الحياتية 
 الكيمياء العضوية
الكيمياء العضوية 
 الكيمياء الفيزيائية
الكيمياء الفيزيائية
 الكيمياء اللاعضوية
الكيمياء اللاعضوية 
 مواضيع اخرى في الكيمياء
مواضيع اخرى في الكيمياء
 الكيمياء الصناعية
الكيمياء الصناعية |
أقرأ أيضاً
التاريخ: 6-5-2020
التاريخ: 16-12-2015
التاريخ: 16-12-2015
التاريخ: 2-5-2020
|
الرابط الذي بربط
الكيماويات التي تترابط
المؤرخ الأمريكي هنري آدمز في (تعاليم هنري آدمز ١٩١٨ )
(نحن نقابل القطبية أو الفعل ورد الفعل في كل جزء من الطبيعة، نقابلها في الظلام والضوء، في الحرارة والبرودة، في المد والجزر، في الذكورة والأنوثة، في شهيق وزفير النباتات والحيوانات، في انقباض وانبساط القلب، وفي موجات السوائل والأصوات، وفي الطرد والجذب المركزي نحو الجاذبية الأرضية، وفي الكهرباء، والجلفانية، وفي الصلة الكيميائية)
لقد كان التوضيح الذي استخدمناه لهذه التجربة، الذي استهللنا به هذه المناقشة هو كأس من شراب المارتيني مع زيتونتين. لكن على عكس خلة الأسنان التي تربط الزيتونتين معاً فإن الرابطة ليست كيانا ماديا. وينبغي أن ندرك أن الرابطة قوة بنفس إدراكنا أن المغناطيسية والجاذبية هما قوة. ومنشأ القوة في الرابطة الكيميائية هو منشأ كهربائي، ولكنها تلك القوة التي يشوبها تعقيدات التجاذب والتنافر، ويوجد فيها الكثير من الإلكترونات والبروتونات والشحنات التي تتحرك بأنماط معقدة. تشبه محاولة تصنيف المواد طبقاً لنوع الرابطة، محاولة طبيب التجميل تصنيف الناس طبقا لدرجة لون البشرة. بالطبع هناك أناس ذو بشرة سوداء وآخرون ذو بشرة بيضاء، لكن هناك الكثير جدا من التنوعات ضمن نطاق بشرة الإنسان. وعلى نفس المنوال يمكننا القول إنه ثمة ثلاث تصنيفات أساسية للرابطة الكيميائية: الأيونية، والتساهمية، والفلزية، لكن هذه جميعها مجرد متغيرات داخل موضوع واحد وهو أن النوى ترتبط معاً عندما يكون هناك انجذاب متبادل، وأن أسس هذا الانجذاب المتبادل هي أسس كهربية. ولدى كل رابطة القليل من خصائص الروابط الأخرى - التساهمية والأيونية والفلزية - لكن بدرجات أكبر أو أقل، ولا يعتبر هذا الغموض مفيداً بصورة مباشرة، إلا أننا سوف نستمر في هذه الدراسة كما لو كان من الممكن أن نضع كل جزيء بشكل قاطع في فئة أو أخرى ثم نستخدم التصنيف كي ننسب خصائص الممواد المختلفة.
أولا: نحن نملك أداة رائعة للتنبؤ بالضبط من أن أي نوع أيون لعنصر ما يميل غالبا للدخول في التفاعل، وهناك أقرب صديق للكيميائي، الجدول الدوري، الذي نعرضه هنا مرة أخرى للمراجعة السهلة.
وكما أشرنا من قبل، يمكن تقسيم الجدول الدوري إلى ثلاثة أجزاء رئيسية: الفلزات واللافلزات وأشباه الفلزات. تقع الفلزات عن يسار السلم المتعرج الذي يبدأ بين البورونB والألمنيوم Al وينتهي بين البولينيوم Po والأستاتين At. تقع اللافلزات عن يمين السلم. وأشباه الفلزات هي تلك العناصر التي تقع مباشرة فوق وأسفل. ولكن مرة أخرى يوجد مدى من الخصائص وليس هناك تمييز قاطع. ولا تأبه الطبيعة لأي مسمى ننتقيه لنلقب سواء الفلزات أو اللافلزات، إلا أن بعض العناصر مثل النحاس Cu (يقع بعد ثلاثة عناصر عن يسار السلم) يقع مباشرة في زمرة الفلزات. وتلك العناصر تحظى بسلوك يشبهبوضوح سلوك الفلزات (فالنحاس الصلب مادة لامعة قابلة للثني وموصل جيد للكهرباء). وتتصرف العناصر الأخرى في زمرة اللافلزات بوضوح مثل اللافلزات: فغازا النيتروجين والأوكسجين هما موصلان ضعيفان جدا للكهرباء لدرجة أن تدفق التيار الكهربائي يمكن أن يتوقف بعزل الأسلاك في الهواء، وعليه يعتبر مبدأ تقسيم الجدول الدوري إلى فلزات ولافلزات مبدأ تقسيم نافع.
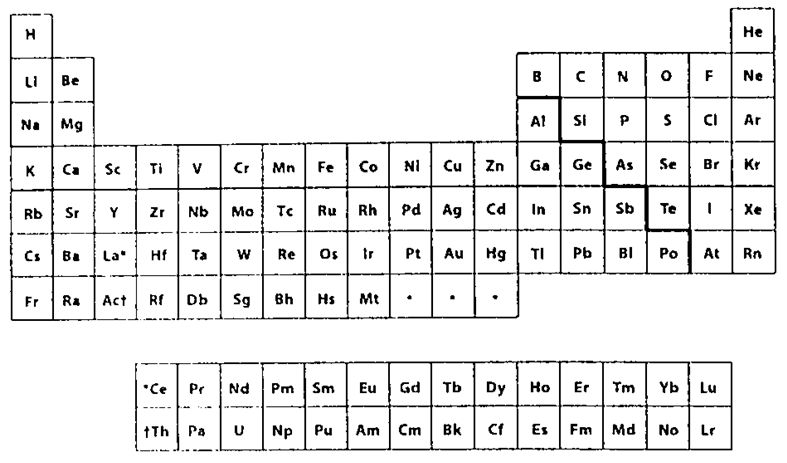
شكل -1: الجدول الدوري للعناصر
وتميل عادة اللافلزات التي تقع عن يمين السلم لأن تكون أيونات سالبة عندما تكؤن أيونات. أما الفلزات التي تقع عن يسار السلم فتميل عادة إلى تكوين أيونات موجبة عند تكوين الأيونات. والشحنات المختلفة تتجاذب؟ فعندما تكون هناك أيونات ذات شحنات مختلفة على مقربة بعضها من بعض، فإنها ينجذب بعضها إلى بعض.
وإذا تكونت رابطة بناء على هذا الانجذاب بين الأيونات، تسمى الرابطة أيونية. فعلى سبيل المثال تعتبر الرابطة بين الصوديوم والكلور في ملح الطعام، كلوريد الصوديوم، خير مثال على ما يعتبر رابطة أيونية، تنشأ الرابطة الأيونية عن الانجذاب بين الأيونات الموجبة والسالبة، كما هو متضمن في الاسم، وفي الرابطة الأيونية يمكن التنبؤ بما سيحدث بشكل دقيق وقابل للتعليل لدرجة أن الفرد غالبا ما يرغب في أن تكون جميع الروابط روابط أيونية سهلة، لكن في ذلك الحين لن يكون لدينا تلك التشكيلة الفعلية التي لا حصر لها من المواد والتى تكون ضوورية لعالمنا، فدائماً ما يكون التنوع عاملا شيقا لكن معقداً وكما لاحظنا من قبل، تتكون الأيونات لأن الذرات تميل لأن تكتسب أو تفقد إلكترونات إلى أن تحصل على طبقة مشبعة التكافؤ. ولأسباب في الماضي سميت الطبقات التامة الامتلاء ثمانيات، مع حقيقة أنه ليست كل الطبقات الممتلئة تحوي ثمانية إلكترونات. ونحن نتحدث عن أيونات تتكون عندما تكتسب الذرة أو تفقد إلكترونات لتشبع ثمانيتها، لكن ثمة بعض الطرق التي يمكن أن تملأ الذرة بها ثمانياتها دون أن تهجر أو تسرق إلكترونات، فمن الممكن أن تكتمل الثمانيات عن طريق مشاركة الإلكترونات أيضا.
تؤدي مشاركة الإلكترون إلى نوعية من الروابط التي عادة تحدث بين لا فلزين (أي عنصرين يقع كل منهما في اليمين الأقصى من الجدول الدوري. ويطلق على هذا النوع من الروابط (الروابط التساهمية ) وكما شاهدنا، إلكترونات التكافؤ هي تلك اللإلكترونات التي تقع في الطبقة الخارجية من الذرة، فعلى سبيل المثال، كل ما يحويه الكربون، الذي يقع في الدورة الرابعة من الصف الثاني، هو ستة إلكترونات (لكونه سادس عنصر مدرجا في الجدول الدوري)، لكن أربعة فقط من هذه الإلكترونات هي إلكترونات تكافؤ أي إلكترونات الطبقة الخارجية. وتعني تساهمية أنه تشارك الإلكترونات على نحو تعاوني وتتصرف الإلكترونات كأنها إلكترونات تكافؤ العنصرين في الرابطة.
ويعتبر المنطق النظري لمشاركة الإلكترونات هو أن كلا من العنصرين في الرابطة التساهمية يملك تقريباً نفس مقدار الجاذبية للإلكترونات. وما من طريقة لتحديد أي العنصرين سيأخذ الإلكترونات وأيهما سيتخلى عنها، نظرا لأن العنصرين يقعان في نفس الجانب من الجدول الدوري ويتشابهان في السالبية الكهربية. ويقع الأوكسجين في الجانب الأيمن من الجدول الدوري، وكما ذكرنا من قبل يحوي الهيدروجين سالبية كهربية مشابهة لعناصر الجانب الأيمن من الجدول، من ثم تكون الرابطة بين الأوكسجين والهيدروجين في الماء رابطة تساهمية. وعندما تنتهي إلكترونات تكافؤ كل من الأوكسجين والهيدروجين من تنظيم نفسها حول النوى، يصبح لكل عنصر ثمانية مكتحلة. (تذكر أن ثمانية الهيدروجين مشبعة بإلكترونين). وتمتلئ ثمانية كل ذرة
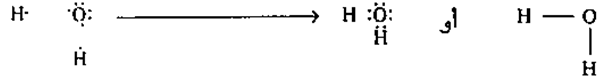
شكل ٢: الروابط التساهمية المتكونة بين الهيدروجين والأوكسجين عندما يملآن طبقاتهما الخاصة بالإلكترونات المتشاركة.
هيدروجين بإلكترونين، أما ثمانية الأوكسجين فتمتلئ بثمانية إلكترونات أربعة منها مشاركة مع نوى الهيدروجين.
إلا أن ثمة تناقضا جوهريا، فقد ذكرنا أن الشحنات المختلفة تتجاذب والمتشابهة تتنافر، وأن لكافة الإلكترونات شحنة سالبة. إذا كان هذا صحيحاً، فلماذا لا تنفجر إذن مجموعات إلكترونات التكافؤ في وبائل متطايرة من الإلكترونات بدلا من التوطد في روابط كيميائية قوية؟
هذا سؤال جيد جدا ونحن مسرورون أنك سألته، وقد اتضح أن هذا السؤال لطالما حير علماء الكيمياء النظريين أيضا، وقد أطلقوا على الجذب الملاحظ بين العناصر (الصلة الكيميائية) لإعطائه اسماً فقط، لكنهم لم يفهموا طبيعة التجاذب، لكن بفهم التركيب الذري وجد مبرر لمثل هذا التجاذب: فيمكن النظر إلى طبيعة التجاذب على أنها إلكترونات سالبة تعمل وسيطا بين النوى المشحونة بشحنات موجبة.
مع أن اكتمال الصورة المحتملة أمر أكثر تعقيدا، فيمكننا أن نجد تشبيها منطقيا في المغناطيس؛ إذا قربنا قضيبي مغناطيس معاً، كان نصفهما معاً سيتنافران. يشبه هذا الموقف إحضار نواتين عاريتين مشحونتين بشحنات موجبة معاً، حيث نجد أنهما لا يرتبطان بسبب التنافر بينهما، لكن بالرجوع إلى المغناطيس نجد أنه إذا وضع قضيب مغناطيسي ثالث بين المغناطيسين اللذين أحضرناهما أولا بحيث يكون القطب الجنوبي موضوعاً إلى جانب القطبين الشماليين، عندئذ يجذب المغناطيس الواقع في الوسط بينهما المغناطيسين الآخرين ويبقى الثلاثة معاً. وفي الرابطة تقوم الإلكترونات السالبة الموجودة بين النوى المشحونة بشحنات موجبة بجذب النوى الموجبة وتتصرف كأنها غراء تلصق النوى معاً.
إلا أن التشبيهات لا تعتبر كاملة البتة؛ فالإلكترونات لا تشغل فراغات محددة بين النوى مثل قضيب المغناطيس الثالث، لكنها تنتشر في سحبغائمة تسمى (مدارات الجزيئات ) التي تأخذ أشكالا غالبا تكون متنوعة في تكويناتها كالتكوينات السماوية التي قارناها بها من قبل. وعندما يكون لأحد هذه المدارات الإلكترونية كثافة إلكترونية كبيرة بين نواتين، يتصوف التكوين كأنه مدار يربط بين النواتين، وإذا أفضت إحدى سحب الإلكترونات هذه إلى كثافة إلكترونية كبيرة خارج النواة، تعمل الإلكترونات على تقليل الترابط بدلا من توطيده. في هذه الحالة تدعى سحابة الإلكترون التي هي مدار الإلكترونSمدار غير رابطR. ويصور هذان الموقفان في الشكل رقم ٣ . ونرى في الجانب الأيسر من الصفحة في شكل ٣ (أ) أن ذرتين اجتمعا معا لذلك توجد بعض الكثافة الإلكترونية بين النواتين، حيث إن الإلكترونات انجذبت إلى النواتين المجاورتين وتكونت الرابطة. ونرى عن يمين الصفحة في شكل ٣ (ب)، أن ذرتين قد اجتمعتا معاً حيث يوجد نقص في الكثافة الإلكترونية بينهما، حيث إن النواتين المشحونتين بشحنات موجبة والمكشوفتين إحداهما للأخرى، تتنافر إحداهما مع الأخرى، ولا تتكون رابطة.
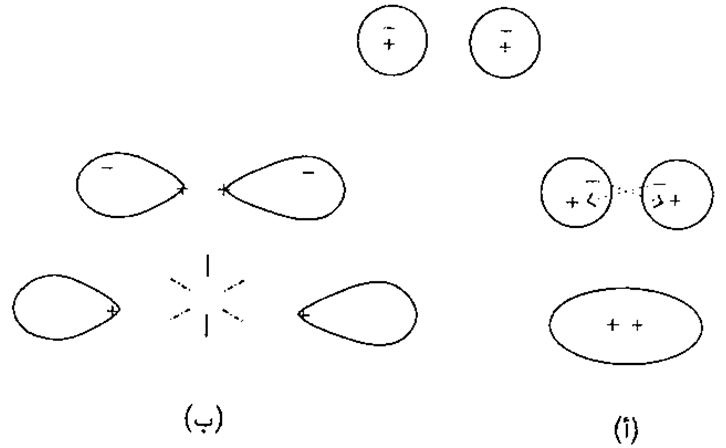
شكل ٣: نجد أنه عندما تجتمع ذرتان قد يجدان نفسيهما (أ) مع سحابة إلكترونية بين النواتين، (ب) تكون السحابة الإلكترونية خارج مركز النواتين. ثمة انجذاب في الحالة الأولى (أ) بين سحابة إلكترونية لأحد الذرات ونواة الأخرى وقد تتكون الرابطة. أما في الحالة الثانية (ب) نجد أن النواتين المشحونتين بشحنات موجبة مكشوفتين إحداهما للأخرى وتتنافر إحداهما مع الأخرى، ولا تتكون الرابطة.
وعادة ما تكون طاقة المدارات غير الرابطة أكبر كثيرا من طاقة مدارات الترابط، لكن إذا اصطدمت الكمية المضبوطة من الطاقة بمدارات الترابط، ربما في شكل طاقة ضوئية، تثار الإلكترونات من أحد المدارات إلى آخر. وإذا أثيرت الإلكترونات فانتقلت من أحد مدارات الترابط إلى أحد المدارات غير الرابطة، فقد تنكسر الرابطة. وتخزن الكثير من المواد مثل بعض الجعة (البيرة) في زجاجات بنية اللون حتى تمنع الضوء من أن يفتت المادة التي بالداخل بنفس هذه الآلية.
وكما ذكرنا من قبل، لا تكون الرابطة دائما أيونية أو تساهمية على نحو خالص، فأفضل نماذج الروابط الأيونية تتضمن بعض المشاركات الإلكترونية، والروابط التساهمية لا تشارك الإلكترونات بالتساوي تماما. وتعني الاختلافات في السالبية الكهربية بين النوى المترابطة أن الإلكترونات ستنجذب إلى أحد النوى أكثر من الأخرى. لكن يمكن اعتبار الرابطة تساهمية بشكل خالص إذا كانت بين نواتين متطابقتين، كما في غاز الهيدروجين H2، أو الأوكسجين O2. وثمة مثال قاطع على المساواة في مشاركة الإلكترونات في الرابطة الفلزية، ففي الفلزات تكون جميع الذرات متطابقة وتشارك الإلكترونات بسهولة حتى إنه يمكن الاعتقاد أن الفلز جزيء واحد كبير.
ويمكن أن يوجد في المواد الصلبة إلكترونات في نظام الترابط بين أزواج النوى تسمى (حزمة التكافؤ)، كما يوجد أيضا مدارات عملاقة تمتد حول كل النواة تسمى (حزمة التوصيل)، ويمكن تخيل حزمة التوصيل على أنها مدار إلكتروني هائل، وفي حزمة التكافؤ تظل الإلكترونات مرتبطة بنواتها. أما في حزمة التوصيل فتحظى الإلكترونات بحرية التحرك من نواة إلى أخرى والتنقل من أحد طرفي الفلز إلى الطرف الآخر. ويمكننا تشبيه الأمر بشبكة بنكية. يوجد على المستوى المحلي بنوك داخل المدينة يعمل بها صيارفة محليون يعيشون ويعملون في نفس المكان، وهؤلاء الصيارفة هم إلكترونات حزمة التكافؤ وظيفتهم الحفاظ على أسس البنك معاً. أما المديرون الأعلى فهم إلكترونات حزمة التوصيل، ووظيفتهم تجعلهم يتنقلون من بنك إلى آخر عبر كل الشبكة.
والمواد التي لديها وفرة من الإلكترونات في حزمة التوصيل تسمى بشكل منطقي جدا، (الموصلات) والطاقة التي تمدها البطاريات تجعل هذه الإلكترونات تنتقل فيما يعرف عامة (بالتيار الكهربي). بعض المواد الصلبة الأخرى لا تملك إلكترونات في حزمة التوصيل ولا توصل الكهربا، وتسمى بالمواد العازلة، والمواد التي تتوسط الموصلات والعوازل تسمى (أشباه الموصلات)، وهو اسم له مردود حميد لمادة ثورية.



|
|
|
|
مخاطر عدم علاج ارتفاع ضغط الدم
|
|
|
|
|
|
|
اختراق جديد في علاج سرطان البروستات العدواني
|
|
|
|
|
|
|
مدرسة دار العلم.. صرح علميّ متميز في كربلاء لنشر علوم أهل البيت (عليهم السلام)
|
|
|