


 النبات
النبات
 الحيوان
الحيوان
 الأحياء المجهرية
الأحياء المجهرية
 علم الأمراض
علم الأمراض
 التقانة الإحيائية
التقانة الإحيائية
 التقنية الحيوية المكروبية
التقنية الحيوية المكروبية
 التقنية الحياتية النانوية
التقنية الحياتية النانوية
 علم الأجنة
علم الأجنة
 الأحياء الجزيئي
الأحياء الجزيئي
 علم وظائف الأعضاء
علم وظائف الأعضاء
 الغدد
الغدد
 المضادات الحيوية
المضادات الحيوية|
Read More
Date: 5-3-2021
Date: 19-12-2015
Date: 10-11-2020
|
Cyclosporin
The cyclosporin family of secondary metabolites from the fungus imperfectus Beauveria nivea are cyclic undecapeptides characterized by an enormous spectrum of biological effects. The most widely used derivative, cyclosporin A (CsA), is immunosuppressive, antiinflammatory, and antichemotactic, and combats multidrug-resistance and viral, fungal, and parasitic infections, without being cytotoxic to mammalian cells (1, 2). Among a number of other N-methyl amino acids, CsA contains an uncommon amino acid at position 1, the (4R)-4([(E)-2-butenyl]-4-N-dimethyl-L-threonine (Fig. 1). Several minor congeners of CsA, designated CsB, CsC ¼ CsZ, have been found as by-products of the fermentation process. The [D-MeVal11]-CsA derivative (CsH) is devoid of most biological effects, thereby serving as a control for nonspecific interactions. Other derivatives have been developed that exhibit a more restricted spectrum of biological activities compared to CsA. For example, [L-MeLeu(3-OH)1,MeAla4,6]-CsA is nonimmunosuppressive but has enhanced antiviral efficacy (3). In the fungus, non-ribosomal synthesis of cyclosporins occurs on a huge, single-chain enzyme with a molecular mass of 1,689 kDa, termed cyclosporin synthetase. It utilizes unmethylated natural amino acids, ATP/Mg2+ and S-adenosyl-L-methionine as starting materials in biosynthesis (4). Besides its use as a powerful tool for unraveling the molecular basis of the cellular immune response, the therapeutic application of CsA has revolutionized the likelihood of success for organ transplantation since its introduction in 1983 (5). Other disorders with immune components, like psoriasis and juvenile diabetes, are relieved with the aid of cyclosporins.
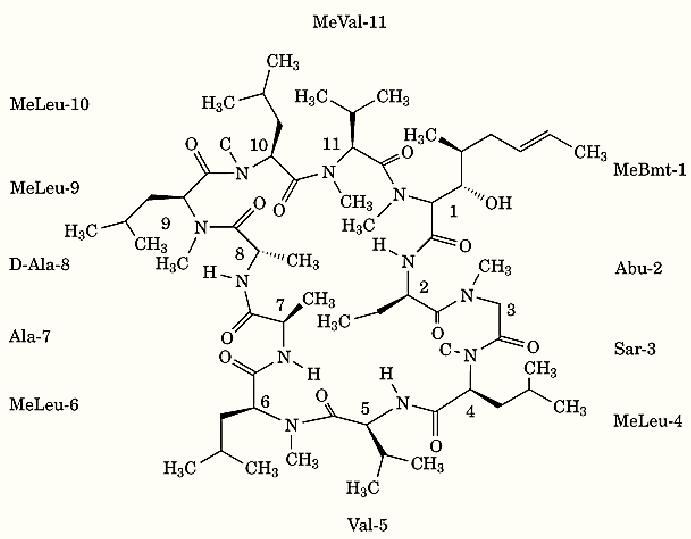
Figure 1. Structure of cyclosporin A.
The dramatic effects of CsA on the cellular immune response, in which the T cells remain in a nonproliferative state, results primarily from the impaired expression of a number of lymphokine genes. This could include a variety of interleukins (IL-2, IL-3, IL-4), factors, such as granulocyte macrophage colony stimulating factor (GM-CSF), tumor necrosis factor a (TNF-a) and g-interferon, and the oncogene c-myc, all synthesized subsequent to antigen stimulation of T cells. Initial investigations identified cytosolic cyclophilin Cyp18 as the specific receptor for CsA in T cells, but minor isoenzymes cannot be completely ruled out yet.
The three-dimensional structure of the inhibitory CsA/Cyp18 complex was determined by X-ray crystallographic and NMR methods (6-8). The structure of Cyp18 is hardly affected by complex formation, whereas that of CsA bound to Cyp18 is dramatically different when in nonpolar organic solvents or in the solid state. In response to the altered conformation of CsA in the complex, the inhibition of the PPIase activity of Cyp18 by CsA is time-dependent, including a cis/trans isomerization of the peptide bond between MeLeu9-MeLeu10. Site-directed mutagenesis of Cyp18 indicates the involvement of a hydrophobic pocket of side-chains, with Trp121 as a major determinant, in the tight binding of CsA to Cyp18, with an inhibition constant, Ki of 2.3 nM. Comparison of Cyp18/substrate complexes with Cyp18/CsA indicates that the peptide chain of CsA runs in the opposite direction. The MeVal11 side-chain of the inhibitor occupies the place of the substrate proline ring.
In some cases, binding of cyclosporins to the targeted cyclophilin and inhibition of its PPIase activity may explain the biological effect of cyclosporins. In contrast, binding of CsA to Cyp18 is necessary, but not sufficient, to arrest signals for the cellular immune response. For example, [MeAla6]-CsA is an excellent inhibitor of the PPIase activity of Cyp18 but has only 1% of the immunosuppressive effect of CsA, whereas the weak inhibitor [MeBm2t1]-CsA (Ki > 1 µM) still shows a considerable fraction of the CsA effect (9).
Thus, for immunosuppression CsA (like FK506 and rapamycin) is best viewed as a pro-drug that is activated functionally when bound to Cyp18 (10). Once formed from the components, the complexes CsA/Cyp18 or FK506/FKBP12 bind to and inactivate reversibly, in a noncompetitive mechanism, the Ca2+- and calmodulin-dependent, heterodimeric protein phosphatase 2B (calcineurin ). This enzyme catalyzes the dephosphorylation of Ser/Thr residues in phosphorylated proteins (11, 12). As a result of dephosphorylation, this enzyme induces the phosphorylated cytoplasmic subunit of NF-AT to translocate into the nucleus for association with the newly synthesized nuclear subunit of NF-AT to form a functional transcription factor (13).
References
1. J. F. Borel, C. Feurer, H. Gubler, and H. Stahelin (1976) Agents Actions 6, 468–475.
2. J. F. Borel (1989) Pharmacol. Rev. 41, 259–371.
3. S. R. Bartz et al. (1995) Proc. Natl Acad. Sci. U.S.A. 92, 5381–5385.
4. A. Lawen and R. Zocher (1990) J. Biol. Chem. 265, 11355–11360.
5. C. R. Stiller (1996) Transplant. Proc. 28, 2005–2012.
6. J. Kallen et al. (1991) Nature 353, 276–279.
7. H. M. Ke et al. (1994) Structure 2, 33–44.
8. S. W. Fesik et al. (1991) Biochemistry 30, 6574–6583.
9. N. H. Sigal et al. (1991) J. Exp. Med. 173, 619–628.
10. S. L. Schreiber (1991) Science 251, 283–287.
11. J. Liu et al. (1991) Cell 66, 807–815.
12. J. Liu et al. (1992) Biochemistry 31, 3896–3901.
13. N. A. Clipstone, D. F. Fiorentino, and G. R. Crabtree (1994) J. Biol. Chem. 269, 26431–26437.

|
|
|
|
اكتشاف تأثير صحي مزدوج لتلوث الهواء على البالغين في منتصف العمر
|
|
|
|
|
|
|
زهور برية شائعة لتر ميم الأعصاب التالفة
|
|
|
|
|
|
قسم التربية والتعليم ينظّم جلسةً حوارية لملاكه حول تأهيل المعلّمِين الجدد
|
|
|
|
جامعة العميد تحدّد أهداف إقامة حفل التخرّج لطلبتها
|
|
|
|
جامعة العميد تحتفي بتخرّج الدفعة الثانية من طلبة كلّية الطبّ
|
|
|
|
قسم الشؤون الفكريّة يشارك في المؤتمر العلمي الدولي الخامس في النجف الأشرف
|