
تاريخ الفيزياء

علماء الفيزياء


الفيزياء الكلاسيكية

الميكانيك

الديناميكا الحرارية


الكهربائية والمغناطيسية

الكهربائية

المغناطيسية

الكهرومغناطيسية


علم البصريات

تاريخ علم البصريات

الضوء

مواضيع عامة في علم البصريات

الصوت


الفيزياء الحديثة


النظرية النسبية

النظرية النسبية الخاصة

النظرية النسبية العامة

مواضيع عامة في النظرية النسبية

ميكانيكا الكم

الفيزياء الذرية

الفيزياء الجزيئية


الفيزياء النووية

مواضيع عامة في الفيزياء النووية

النشاط الاشعاعي


فيزياء الحالة الصلبة

الموصلات

أشباه الموصلات

العوازل

مواضيع عامة في الفيزياء الصلبة

فيزياء الجوامد


الليزر

أنواع الليزر

بعض تطبيقات الليزر

مواضيع عامة في الليزر


علم الفلك

تاريخ وعلماء علم الفلك

الثقوب السوداء


المجموعة الشمسية

الشمس

كوكب عطارد

كوكب الزهرة

كوكب الأرض

كوكب المريخ

كوكب المشتري

كوكب زحل

كوكب أورانوس

كوكب نبتون

كوكب بلوتو

القمر

كواكب ومواضيع اخرى

مواضيع عامة في علم الفلك

النجوم

البلازما

الألكترونيات

خواص المادة


الطاقة البديلة

الطاقة الشمسية

مواضيع عامة في الطاقة البديلة

المد والجزر

فيزياء الجسيمات


الفيزياء والعلوم الأخرى

الفيزياء الكيميائية

الفيزياء الرياضية

الفيزياء الحيوية

الفيزياء العامة


مواضيع عامة في الفيزياء

تجارب فيزيائية

مصطلحات وتعاريف فيزيائية

وحدات القياس الفيزيائية

طرائف الفيزياء

مواضيع اخرى
مستويات طاقة الهيدروجين
المؤلف:
فريدريك بوش ، دافيد جيرد
المصدر:
اساسيات الفيزياء
الجزء والصفحة:
ص 1042
10-7-2016
29102
مستويات طاقة الهيدروجين
ان ذرة الهيدروجين لابد أن تكون لها حالات مستقرة تكون فيها الذرة ثابتة متزنة. وقد توصلت النظرية التي ألممنا بها إلى أن تلك الحالات المستقرة تتكون من مدارات دائرية ذات أنصاف أقطار تعطى، في حالة الهيدروجين، بالعلاقة:
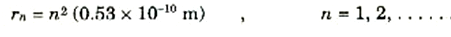
ويوضح الشكل 1)) المدارات القليلة المستقرة الأولى، وسنتعرف الآن على الطاقة التي للذرة في لك من هذه الحالات.
لابد لكل من الحالات المستقرة التي وجدناها من طاقة مميزة لها. وطاقة الذرة تتكون من شقين، أحدهما هو طاقة حركة الإلكترون عندما يتحرك في مداره، وتعطى هذه الطاقة ــ بالنسبة للمدار رقم n بالعلاقة،
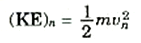

الشكل 1)): يقوم الإلكترون بالدوران حول النواة في سلسلة من المدارات المستقرة التي تحقق شرط الرنين، ولن تتاح له أية مدارات أخرى مستقرة وحجم النواة في الشكل مبالغ فيه إلى حد كبير.
حيث أمكن لنا إهمال ظواهر النسبية؛ تصبح هذه العلاقة
(1) 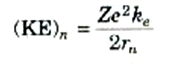
ويمتلك الإلكترون بالإضافة إلى طاقة حركته، طاقة وضع كهربية سالبة. ويرجع السبب في كونها سالبة إلى أننا نعرف طاقة وضع شحنتين على أنها تساوي الصفر عندما تكون المسافة بينهما لا نهائية. وكلما اقترب الإلكترون من النواة، فإنه "ينحدر" بالنسبة لطاقة الوضع لأن النواة تجذبه، أي أنه يتحرك نحو طاقات وضع أقل من الصفر أي سالبة. وطاقة وضع إلكترون يقع على مسافة ra من شحنة موجبةZe هي
(2) 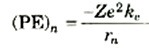
فإذا أضفناها إلى طاقة حركة الإلكترون في المدار رقم n(المعادلة (1)) فإننا نحصل على الطاقة الكلية للذرة في الحالة المستقرة رقم n:
(3) 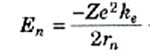
يلاحظ أن طاقة الذرة سالبة وتصبح أكثر سالبية كلما انخفضت قيمة rn(وبعبارة اخرى: كلما اقترب الإلكترون من النواة).
يمكننا الآن كتابة المعادلة (3) على طورة أكثر ملاءمة للتعويض عن قيمة rn:
(4) 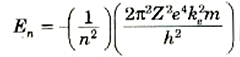
وإذا عوضنا عن قيم الثوابت الواردة في هذه المعادلة فإننا نحصل على Z = 1 على:
(5) 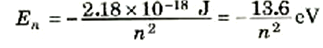
ومعنى الطاقة الكلية السالبة هو أن الإلكترون مرتبط بالنواة، ولو أنه اكتسب ما يكفى من الطاقة من أحد المصادر الخارجية (بالتصادم مثلاً، حتى تصبح طاقته الكلية موجية، فإن لن يصبح مرتبطاً: بل سيصير حراً.
ولنتذكر أن كل قيمة من قيم n تناظر حالة مستقرة واحدة للذرة. فالحالة n =1، في إطار النموذج شبه الكلاسيكي، تناظر إلكتروناً يدور في أصغر مدار ممكن له r1 وتسمى طاقة الذرة في هذه الحالة، الحالة الأرضية وهي تساوي E1 = -13.6 eV، ولما كانت النظم إذا خلى بينها وبين أية مؤثرات خارجية تميل إلى الهبوط إلى أدنى طاقة ممكنة، فإن ذرات الهيدروجين توجد عادة في الحالة n = 1. وعندما n = 2، وهي تناظر حالة الطاقة الأعلى التالية، فإن نصف قطر المدار يصبح 4πr، وعندئذ تصبح طاقة الذرة هي:
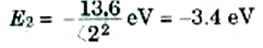
يلاحظ هنا أن E2 أكبر من E1، بمعنى ان طاقة الذرة في الحالة 2 أعلى من طاقتها في الحالة 1. وسنكتب على سبيل المثال الإيجاز:
(6) 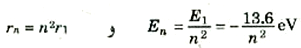
وكما هو واضح فإن طاقات الإلكترون في الذرة مكماة مثلما كانت حالة الجسيم المحصور داخل انبوبة.
من المناسب دائماً أن نمثل طاقات النظام المكماة (كالذرات مثلاً) على هيئة ما يسمى الرسم البياني لمستويات الطاقة؛ وبالنسبة لذرة الهيدروجين فإنه موضح بالشكل 2)). وهو بمثابة مقياس رأسي للطاقة مع خطوط أفقية مرسومة بحيث تناظر طاقات الحالات المستقرة للذرة. وقد بينا عدة مستويات أولى فقط، لأن تلك المستويات تصير عند قيم n الأعلى من ذلك متلاصقة لدرجة يصعب معها رسمها. ويتضح هذا من حقيقة أن كل المستويات بدءاً من n = 3 حتى n = ∞ لابد أن تقع داخل فجوة صغيرة بين – 1.51 eV والصفر. وحيث أن نصف قطر المدار يتزايد بسرعة بزيادة n فإن الإلكترون يصير متحرراً من النواة تماماً عند n = ∞، وتصير الذرة عندئذ مؤينة.
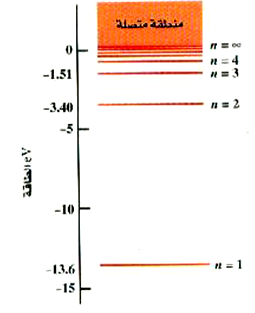
الشكل 2)): الرسم البياني لمستويات طاقة الهيدروجين. هناك عدد لا نهائي من المستويات فيما بين n = 4 و n = ∞.
نلاحظ أن هناك منطقة بالتعبير منطقة متصلة، وتقع لطاقات أكبر من الصفر. وعند قيمة n = ∞ يكون الإلكترون متحرراً من الذرة ويكون ساكناً. وتكون قيم الطاقة الأعلى بمثابة طاقة الحركة الانتقالية للإلكترون الحر. ولكن هذه الطاقة ليست مكماة ولذلك فإن جميع قيم الطاقة فوق E = 0 تكون متاحة.
 الاكثر قراءة في الفيزياء الذرية
الاكثر قراءة في الفيزياء الذرية
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة

الآخبار الصحية















 قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة
قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة "المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة
"المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة (نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)
(نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)


















