
تاريخ الفيزياء

علماء الفيزياء


الفيزياء الكلاسيكية

الميكانيك

الديناميكا الحرارية


الكهربائية والمغناطيسية

الكهربائية

المغناطيسية

الكهرومغناطيسية


علم البصريات

تاريخ علم البصريات

الضوء

مواضيع عامة في علم البصريات

الصوت


الفيزياء الحديثة


النظرية النسبية

النظرية النسبية الخاصة

النظرية النسبية العامة

مواضيع عامة في النظرية النسبية

ميكانيكا الكم

الفيزياء الذرية

الفيزياء الجزيئية


الفيزياء النووية

مواضيع عامة في الفيزياء النووية

النشاط الاشعاعي


فيزياء الحالة الصلبة

الموصلات

أشباه الموصلات

العوازل

مواضيع عامة في الفيزياء الصلبة

فيزياء الجوامد


الليزر

أنواع الليزر

بعض تطبيقات الليزر

مواضيع عامة في الليزر


علم الفلك

تاريخ وعلماء علم الفلك

الثقوب السوداء


المجموعة الشمسية

الشمس

كوكب عطارد

كوكب الزهرة

كوكب الأرض

كوكب المريخ

كوكب المشتري

كوكب زحل

كوكب أورانوس

كوكب نبتون

كوكب بلوتو

القمر

كواكب ومواضيع اخرى

مواضيع عامة في علم الفلك

النجوم

البلازما

الألكترونيات

خواص المادة


الطاقة البديلة

الطاقة الشمسية

مواضيع عامة في الطاقة البديلة

المد والجزر

فيزياء الجسيمات


الفيزياء والعلوم الأخرى

الفيزياء الكيميائية

الفيزياء الرياضية

الفيزياء الحيوية

الفيزياء العامة


مواضيع عامة في الفيزياء

تجارب فيزيائية

مصطلحات وتعاريف فيزيائية

وحدات القياس الفيزيائية

طرائف الفيزياء

مواضيع اخرى
الأعداد الكمية ومبدأ بأولى للاستبعاد
المؤلف:
فريدريك بوش ، دافيد جيرد
المصدر:
اساسيات الفيزياء
الجزء والصفحة:
ص 1054
10-7-2016
6085
الأعداد الكمية ومبدأ بأولى للاستبعاد
تتواجد ذرة الهيدروجين وإلكترونها في مستويات طاقة محددة ومعلومة، يميزها عدد صحيح هو n، وتتحدد بالعلاقة:
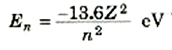
حيث Z =1 في حالة الهيدروجين. وتتراوح قيمة العدد الصحيح n من 1 إلى ما لانهاية كلما اتخذت الذرة قيماً مسموحاً بها مختلف للطاقة. وعلى الرغم من توصلنا إلى هذه النتيجة باستخدام نموذج بوهر، إلا أن الصورة الموجية التي تقوم على حل معادلة شرودنجر، تؤدي إلى نفس النتيجة. ونرى من ثم أن العدد n، يمثل بارامتراً أساسياً وضرورياً لوصف حالة ذرة الهيدروجين. وكما ذكرنا من قبل لأنه يسمى العدد الكمي الرئيسي. وهو يميز مستوى الطاقة الذي على الإلكترون أن يتواجد فيه. وقد تصور بوهر أن كل قيمة للعددn يصاحبها مدار خاص للإلكترون وإن كان قد ثبت عدم وجود سند لهذا. ومع ذلك، فمن الشائع أن يقال أن كل قيمة للعدد n تناظر قشرة طاقة معينة (بدلاً من تناظر مداراً معيناً) تحيط بالنواة. وعندما تكون الذرة في مستوى الطاقة n =3، مثلاً، فإنه يقال ــ في العادة ــ أن الإلكترون موجود في القشرة n =3.
أن من الممكن وجود أكثر من شكل من الرنين الموجي بالنسبة لنفس قيمة العدد الكمي الرئيسي. وتنص النظرية الموجية على أن هناك عدسة كميين آخرين لابد من تقديمهما حتى يتم تحديد رنين موجي معين داخل الذرة. ويرتبط أحد هذين العددين، وهو العدد الكمي المداري، بكمية التحرك الزاوية لإلكتروني بوهر في مداره الرنين. ويمثل هذا العدد بالحرف n = 1، مثلاً ، فإن القيم الممكنة بالنسبة للعدد l ستكون محددة بقيمة منفردة وهي I = 0. وعندما يكون n =2، فإن من الواضح أن l سيتخذ القيمتين 0 و 1، حيث أن n -1 =1 في هذه الحالة. يلاحظ بالطبع أن l أقل دائماً من n.
أما العدد الكمي الثالث فيسمى العدد الكمي المغناطيسي ، ml ، ويمكن أن يتخذ القيم 0, ±1, ±2,..... ويصف هذا العدد الاتجاهات الممكنة لكمية التحرك الزاوية للإلكترون عندما يتواجد في مجال مغناطيسي خارجي. وعندما يكون n =4، مثلاً، فإن أكبر قيمة ممكنة للعدد l هي 3، يتخذ العدد ml القيم 0, ±1, ±2,.... وبعبارة اخرى، فعندما يكون الإلكترون في مستوى الطاقة المناظر للعدد n =4، فإن هناك سبعة مدارات ممكنة للعدد l = 3. وبالإضافة إلى ذلك ستكون هناك خمسة مدارات ممكنة للعدد l =2، وثلاثة مدارات للعدد l =1، ومدار واحد للعدد l =0 . أي أن الذرة يمكن أن تتواجد في (16) تشكيل إلكتروني رنيني مختلف، عندما توجد في مستوى الطاقة n =4.
هناك شرط كمي للإلكترون نفسه، فهو يمتلك عزماً مغناطيسياً صغيراً بفضل كونه جسيماً مشحوناً يدور حول نفسه في حركة مغزلية. ولا يتخذ عزمه المغناطيسي سوى اتجاهين فقط بالنسبة لمجال مغناطيسي خارجي: فهو إما مواز له او مواز ومضاد. ويمكننا تمييز هذين الوضعين بأن تعين للإلكترون عدد لف كمي، ms ، ذي قيمتين ممكنتين هما 1/2±، وتمثل الإشارتان الاتجاهين المتاحين وهما الاتجاه الموازي والاتجاه الموازي والمضاد. ويلخص الجدول (1) الأعداد الكمية الأربعة اللازمة لوصف حالة إلكترون في ذرة ما. وسوف نطلق على كل مجموعة مكونة من الأربعة أعداد الكمية، حالة إلكترونية للذرة. وسنرى على الفور أن هناك مبدأ بالغ الأهمية، ينطبق على سلوك الإلكترونات في الحالات المتاحة.
لقد اولى العالم فولفجانج بأولى عام 1925 اهتمامه الشديد لأول مرة بتحديد هذه الحالات الإلكترونية، ورغب في تعميم هذه المفاهيم لتشمل ذرات أخرى غير الهيدروجين. وتوصل إلى الاستنتاج التالي الذي عرف بمبدأ بأولى للاستبعاد. لكي يتمكن من تعيين حالات محددة الإلكترونات المختلفة في الذرات عديدة الإلكترونات بشكل صحيح.
لا يمكن لإلكترونين في ذرة ما أن يتخذا نفس مجموعة الأعداد الكمية الأربعة أي انه لا يمكن لإلكترونين أن يتواجدا في نفس الحالة.
إن هذا المبدأ اساسي لفهم التركيب الإلكتروني للذرات.

 الاكثر قراءة في الفيزياء الذرية
الاكثر قراءة في الفيزياء الذرية
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة

الآخبار الصحية















 قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة
قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة "المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة
"المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة (نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)
(نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)


















