


 علم الكيمياء
علم الكيمياء 
 الكيمياء التحليلية
الكيمياء التحليلية 
 الكيمياء الحياتية
الكيمياء الحياتية 
 الكيمياء العضوية
الكيمياء العضوية 
 الكيمياء الفيزيائية
الكيمياء الفيزيائية
 الكيمياء اللاعضوية
الكيمياء اللاعضوية 
 مواضيع اخرى في الكيمياء
مواضيع اخرى في الكيمياء
 الكيمياء الصناعية
الكيمياء الصناعية |
أقرأ أيضاً
التاريخ: 8-7-2018
التاريخ: 11-9-2018
التاريخ: 21-2-2017
التاريخ: 2024-02-28
|
نقطة الغليان Boiling point
بالرغم من أن الجسيمات في السائل تترتب بانتظام أقل، وتتحرك بحرية أكبر مما هو في البلورة، إلا أن كل جسيم يعاني من جذب عدد من الجسيمات الأخرى. يتضمن الغليان، انتزاع جزيئات مفردة أو اشفاع من الأيونات المتعاكسة الشحنة، من السائل (انظر الشكلين 1.1 و 2.1). يحصل هذا الأمر عندما نصل الى درجة الحرارة التي تكون فيها الطاقة الحرارية للجسيمات كبيرة بكفاية للتغلب على قوى التلاحم التي تبقيها في السائل.
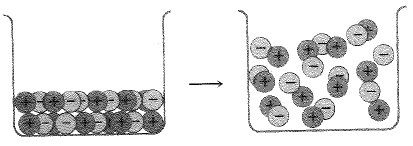
الشكل 1.1: غليان سائل أيوني. الوحدات أيونات وأزواج أيونات.
تكون في الحالة السائلة وحدة المركب الأيوني هي الأيون. ويتثبت كل أيون بقوة، بعدد من الأيونات الأخرى المعاكسة له بالشحنة. ومرة ثانية، لا يوجد هنا شيء يمكننا تسميته جزيئاً، بشكل صحيح. ويلزم بذل مقدار كبير من الطاقة لانتزاع زوجين من الأيونات المتعاكسة بالشحنة من السائل؛ ولذلك لا يحصل الغليان إلا في درجة حرارة مرتفعة. تبلغ نقطة غليان كلوريد الصوديوم، مثلاً، 1413˚س. ويوجد في الحالة الغازية بشكل زوجين من الأيونات يمكن النظر اليهما كأنهما جزيء كلوريد الصوديوم.
ومرة أخرى تكون الوحدة في الحالة السائل لمركب غير أيوني هي الجزيء. ويجري التغلب على القوى الجزيئية الداخلية الضعيفة وهي هنا التآثرات ثنائي قطب –ثنائي قطب- وقوى فان ديرفالس، بسهولة أكبر مما يصادف في حالة القوى الأيونية الداخلية الشديدة الموجودة في المركبات الأيونية، وذلك يحدث الغليان في درجة حرارة أخفض بكثير. يغلي الميتان غير القطبي في الدرجة 161.5˚س، وحتى أن جزيء كلوريد الهيدروجين القطبي، يغلي في الدرجة 85˚س.
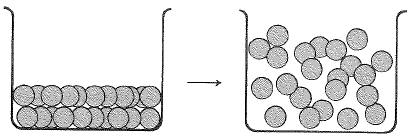
الشكل 2.1: غليان السائل غير أيوني. اللوحات هي جزيئات.
تدعى السوائل التي تتماسك جزيئاتها بروابط هيدروجينية، (السوائل المترابطة associated liquids). ويتطلب تحطيم هذه الروابط الهيدروجينية، قسطاً كبيراً من الطاقة، ولذلك تكون نقطة غليان سائل مترافق أعلى، بصورة غير اعتيادية مما يجب أن تكون عليه في سائل له نفس الوزن الجزيئي وذات عزم ثنائي القطب. فمثلاً، يغلي فلوريد الهيدروجين بدرجة أعلى بـ 700˚س من كلوريد الهيدروجين الأثقل وغير المترافق؛ وكذلك يغلي الماء بدرجة أعلى بـ 160˚س من كبريتيد هيدروجين.
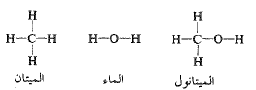
وتوجد، أيضاً مركبات عضوية يكون فيها الهيدروجين مرتبطاً، مع الاكسجين أو مع النتروجين، وهنا، أيضاً، تصادف الروابط الهيدروجينية. لنأخذ الميتان مثلاً، ولنستبدل بأحد هيدروجيناته، زمرة هيدروكسيلية (-OH). يكون المركب الناتج هو (CH3OH) أي الميتانول، الفرد الأصغر في أسرة الكحولات. يشبه هذا المركب في البنية الميتان، وكذلك الماء:
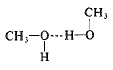
والميتانول كالماء سائل مترافق له نقطة غليان أكبر، بشكل غير اعتيادي من نقطة غليان أي سائل له نفس حجمه وقطبيته.
وكلما كانت الجزيئات أكبر اشتدت قوى فان دير فالس، حين تبقى الأمور الأخرى كما هي – مثل القطبية، والترابط الهيدروجيني – إلا أن نقاط الغليان تزداد بازدياد الحجم الجزيئي. تتدرج نقاط غليان المركبات العضوية الارتفاع ابتداء من تلك التي لجزيء الميتان الصغير، غير القطبي، لكن نادراً، ما نصادف نقاط غليان أعلى من 350˚س بكثير؛ ففي درجات الحرارة الأعلى تبدأ الروابط المشتركة في الجزيء بالتحطم، فيحدث التفكك مع حدوث الغليان لذلك، يستخدم التقطير تحت الضغط المنخفض، لإنقاص نقاط الغليان، بغية خفض التفكك الى حده الأدنى أثناء تقطير المركبات العضوية.



|
|
|
|
التوتر والسرطان.. علماء يحذرون من "صلة خطيرة"
|
|
|
|
|
|
|
مرآة السيارة: مدى دقة عكسها للصورة الصحيحة
|
|
|
|
|
|
|
نحو شراكة وطنية متكاملة.. الأمين العام للعتبة الحسينية يبحث مع وكيل وزارة الخارجية آفاق التعاون المؤسسي
|
|
|