


 علم الكيمياء
علم الكيمياء 
 الكيمياء التحليلية
الكيمياء التحليلية 
 الكيمياء الحياتية
الكيمياء الحياتية 
 الكيمياء العضوية
الكيمياء العضوية 
 الكيمياء الفيزيائية
الكيمياء الفيزيائية
 الكيمياء اللاعضوية
الكيمياء اللاعضوية 
 مواضيع اخرى في الكيمياء
مواضيع اخرى في الكيمياء
 الكيمياء الصناعية
الكيمياء الصناعية |
أقرأ أيضاً
التاريخ: 14-9-2020
التاريخ: 6-6-2016
التاريخ: 20-10-2020
التاريخ: 16-10-2019
|
الرابطة التساهمية The covalent bond
لندرس الآن تشكل جزيء ما. وللتبسيط سنصور الأمر كأنه يحدث نتيجة التحام المفردة، بالرغم من أن أغلب الجزيئات لا تشكل بهذه الطريقة. إننا نقوم بصنع نماذج للجزيئات من الخشب أو بوساطة الكرات البلاستيكية تمثل مختلف الذرات؛ وتدلنا مواقع الثقوب ووصلات التثبيت كيف نجمعها بعضها مع بعض. وسنقوم بنفس الأسلوب، بصنع نماذج تخيلية للجزيئات باستخدام ذرات تخيلية؛ إن مواقع المدارات الذرية – بعضها تخيلي – ستدلنا الى طريقة تجميع هذه الذرات بعضها مع بعض.
ولكي تشكل رابطة مشتركة، يجب أن تتوضع ذرتان بحيث يتراكب overlap أحد مدارات واحدة منهما مع مدار الذرة الأخرى، ويجب أن يشغل كل مدار إلكتروناً مفرداً. وعندما يحدث ذلك يندمج المداران مشكلين مداراً رابطاً مفرداً يشغله كلا الالكترونين. ويجب أن يكون للالكترونين اللذين يشغلان مداراً رابطاً يلف ذاتي متعاكس، أي يجب أن يكونا زوجين. ويكون المدار الرابط متاحاً بكليته لكل من الالكترونين، ويجب أن نفترض أنه ينتمي لكل من نواتي الذرتين.
يوافق هذا الترتيب للالكترونات والنوى، طاقة أقل – أي استقرار أكبر – من الترتيب الموافق للذرات المعزولة؛ وبالنتيجة، فإن تشكل الرابطة يترافق بتحرر الطاقة. يدعى مقدار الطاقة (لكل مول) المعطى عند تشكل رابطة (أو مقدار الطاقة اللازم تقديمه لكسر الرابطة) طاقة تفارق الرابطة bond dissociation cnergy. ففي حالة زوجين من الذرات تكون الرابطة أقوى كلما كان التراكب بين المدارات الذرية أكبر.
ما الذي يعطي الرابطة المشتركة قوتها؟ إنه التزايد في التجاذب الكهرساكن. يكون لكل الكترون في الذرات المعزولة مجذوباً – وجاذباً – لنواة موجبة واحدة. أما في الجزيء، فيكون كل الكترون مجذوباً الى نواتين موجبتين اثنتين وكذلك جاذباً لهما.
إنه مفهوم التراكب الذي يوفر الجسر التخيلي بين المدارات الذرية والمدارات الرابطة. يعني تراكب المدارات الذرية أن المدار الرابط يشغل معظم المنطقة من الفراغ الذي كان يشغلها المداران الذريان كلاهما. وبالنتيجة يستطيع الكترون ذرة ما، ولمدة طويلة، البقاء في موقعه الأصلي المفضل بالنسبة الى نواته، وبنفس الوقت يشغل موقعاً مفضلاً مشابهاً بالنسبة الى النواة الثانية، وينطبق الأمر ذاته، بالطبع، على الالكترون الآخر.
لقد درس التراكب الأعظمي لأول مرة لينوس باولينغ L. Pauling عام 1931 (في معهد كاليفورنيا للتقانة)، وقد صنف في درجة أدنى من مبدأ الاستبعاد من حيث أهميته لفهم البنية الجزيئية.
وكما في مقالنا الأول، لندرس تشكل جزيء الهيدروجين، H2، من ذرتي هيدروجين، تملك كل ذرة هيدروجينية الكتروناً واحداً، يشغل المدار 1s. كما رأينا فإن المدار 1s هو كرة ينطبق مركزها على نواة الذرة. ولكي تتشكل الرابطة، يجب أن تقترب النواتان الى درجة تكفي لحدوث تراكب المدارات الذرية . وفي حالة الهيدروجين تكون المنظومة في حالة الاستقرار الاعظمي عندما تكون المسافة بين النواتين مساوية A 0.74، تدعى هذه المسافة "طول الرابطة" bond length"، يتوازن عند هذه المسافة التأثير الاستقراري للتراكب تماماً مع قوة تدافع بين النواتين المتماثلتي الشحنة. يحتوي جزيء الهيدروجين الناتج طاقة أقل بمقدار 104 كيلو حريرة/مول من مجموع طاقتي ذرتي الهيدروجين المشكلتين له. ونقول، عندئذٍ، أن طول الرابطة هيدروجين – هيدروجين يساوي A 0.74 وأن قوتها تساوي 104 كيلو حريرة/مول.
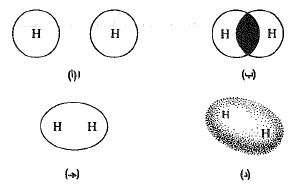
الشكل 3.1: تشكل الرابطة: جزيء H2. (أ) مداران s منفصلان. (ب) مداران s متراكبان. (جـ) و (د) مدار الرابطة a.
يملك المدار الرابط، تقريباً، الشكل الذي نتوقعه لدى اندماج مدارين من نوع s. وكما يظهر (الشكل 3.1) فإنه على هيئة النقانق sausage بحيث يتوضع محورها الطويل وفق الخط الواصل بين تجمع النواتين. وهو مدار متناظر أسطوانياً حول هذا المحور الطويل، أي أن مقطع النقانق يكون دائري. تسمى المدارات الرابطة التي لها هذا الشكل المدارات a (مدارات سيغما) وتدعى الروابط، الروابط a. ويمكن أن نصور جزيء الهيدروجين على شكل نواتين مغمورتين ضمن سحابة الكترونية واحدة على هيئة النقانق. تكون هذه السحابة أكثف ما يمكن في المنطقة الواقعة بين الذرتين، حيث تجذب الشحنة السالبة أشد ما يمكن من قبل الشحنتين الموجبتين.
إن حجم جزيء الهيدروجين – كما قيس بواسطة الحجم الموجود داخل السطح الاحتمالي 95% أصغر بكثير من حجم ذرة الهيدروجين المفردة. قد نستغرب ذلك في البداية، إلا أن تناقص السحابة الالكترونية هو ما يجب أن نتوقعه. إن الجذب الهائل الذي تقوم به النواتان للالكترونين هو الذي يعطي الجزيء استقراره الكبير بالمقارنة مع الذرتين المعزولتين؛ وهذا يجب أن يعني أن الالكترونين قد ثبتا بشكل وثيق في موقع أقرب مما عليه الحال في الذرتين.
لندرس الآن تشكل جزيء الفلور، F2، من ذرتي فلور. إن الفلور يملك الكترونين في المدار 1s، والكترونين في المدار 2s، والكترونين في كل من المدارين 2p، والكتروناً واحداً في المدار 2p الثالث، وهو الكترون مفرد ومتوافر لتشكيل رابطة. يسمح تراكب هذا المدار مع مدار آخر مماثل تابع لذرة فلور أخرى، بتزاوج الالكترونين المفردين وتشكيل الرابطة . تتركز الشحنة الالكترونية بين النواتين، وهكذا فإن الانتفاخ الخلفي لكل من المدارين المتراكبين يتقلص الى حجم صغير نسبياً. وعلى الرغم من أن الرابطة فلور – فلور قد تشكلت نتيجة تراكب مدارات من نوع مختلف إلا أن لها نفس الشكل العام الذي
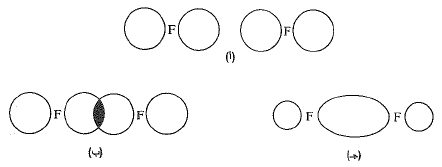
الشكل 1.1: تشكل رابطة: جزيء F2. (أ) المدارات p منفصلة. (ب) تراكب المدارات p. (جـ) مدار الرابطة a.
للرابطة هيدروجين – هيدروجين، أي أنها ذات تناظر أسطواني حول الخط الواصل بين النواتين؛ وتسمى كذلك رابطة a. يبلغ طول الرابطة فلور – فلور 1.42 A وتبلغ قوتها نحو 38 كيلو حريرة/مول.
وكما تبين الأمثلة، فإن الرابطة المشتركة تنتج عن تراكب مدارين ذريين لتشكيل مدار رابط بشغله زوجان من الالكترونان. ويكون لكل نوع من الروابط المشتركة طول وقوة تميزاها عن غيرها.



|
|
|
|
"عادة ليلية" قد تكون المفتاح للوقاية من الخرف
|
|
|
|
|
|
|
ممتص الصدمات: طريقة عمله وأهميته وأبرز علامات تلفه
|
|
|
|
|
|
|
المجمع العلمي للقرآن الكريم يقيم جلسة حوارية لطلبة جامعة الكوفة
|
|
|