


 علم الكيمياء
علم الكيمياء 
 الكيمياء التحليلية
الكيمياء التحليلية 
 الكيمياء الحياتية
الكيمياء الحياتية 
 الكيمياء العضوية
الكيمياء العضوية 
 الكيمياء الفيزيائية
الكيمياء الفيزيائية
 الكيمياء اللاعضوية
الكيمياء اللاعضوية 
 مواضيع اخرى في الكيمياء
مواضيع اخرى في الكيمياء
 الكيمياء الصناعية
الكيمياء الصناعية |
أقرأ أيضاً
التاريخ: 2024-02-03
التاريخ: 2024-02-04
التاريخ: 2023-09-19
التاريخ: 2-5-2017
|
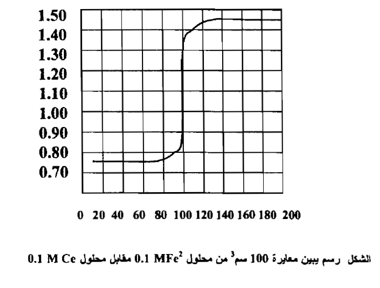
تغير جهد القطب في أثناء معايرة مادة مختزلة بمادة مؤكسدة . وفي حالة المعايرة التأكسدية يمكن أن نأخذ أولاً مثالاً على ذلك حالة بسيطة من هذا النوع من التفاعلات التي تتضمن تبدلاً تكافئيا فقط في الأيونات ، ولا تعتمد نظرياً على تركيز الهيدروجين والمثال الملائم لهذه الأغراض التوضيحية معايرة 100سم3 من محلول N Fe(II) مع سيريوم 0.1 بوجود حامض الكبريتيك المخفف .
ان معادلة التفاعل التأكسدية الاختزالية لهذا التفاعل هي
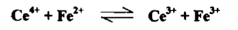

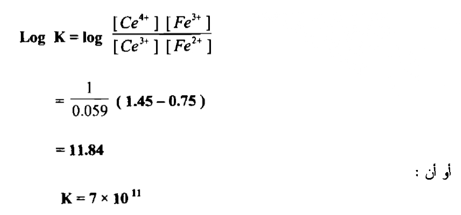
وتدل قيمة ثابت التوازن الايجابية العالية علي أن التفاعل يجري بصـــــورة تـامــــة وكاملة وهو صالح لإجراء المعايرة والتعين الكمي للحديد في أثناء زيادة محلول سيريوم (IV) إلى أن تصل إلى نقطة التكافؤ يكون تأثيره هو في أكسدة الحديد الثنائي وبالنتيجة تبدل النسبة .
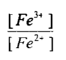
فعند زيادة 10سم3 من محلول الكاشف المؤكسد وهو محلول Ce+4 إلى 100 سم3 من محلول الحديد الثنائي يصبح الحجم الكلي 110سم وعليه فإن تركيز Fe+3 المتكون يكون :



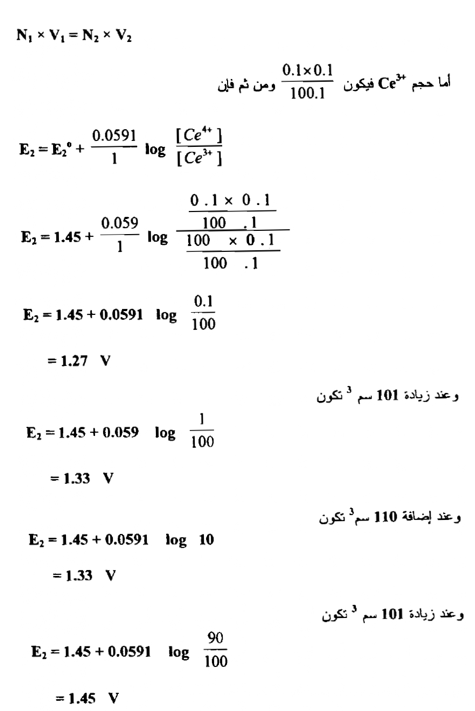
ومن ربط العلاقة بين الحجوم المزادة من محلول الكاشف المؤكسد وقيم جهود الاختزال المحسوبة نحصل علي الشكل التالي
ولغرض استنتاج الصيغة الرياضية التي مر ذكرها لحساب جهد القطب عند نقطة التكافؤ نتبع ما يأتي :
فللتفاعل التأكسدي الاختزالي .
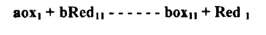
حيث a , b عدد الالكترونات المفقودة والمكتسبة في الحالتين يكون الجهد عند نقطة التكافؤ
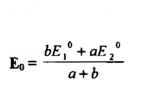

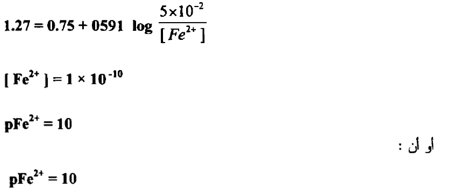
وهكذا فإن pFe2+ تتغير عن 4.3 إلى 10 بين 0.1 % قبل و 0.1 % بعد نقطــــة التكافؤ ، إن هذه المقادير ذات أهمية في اختيار الدلائل لاكتشاف نقطة التكافؤ ومن الواضح أن التغير الحاد في الجهد حوالي نقطة التكافؤ يعتمد علي الجهود القياسية لمنظومتي التأكسد والاختزال المتعلقتين ببعضها وعلي ثابت التوازن للتفاعل وهو معتمد على التركيز ما لم تكن صغيرة جداً .


|
|
|
|
"عادة ليلية" قد تكون المفتاح للوقاية من الخرف
|
|
|
|
|
|
|
ممتص الصدمات: طريقة عمله وأهميته وأبرز علامات تلفه
|
|
|
|
|
|
|
المجمع العلمي للقرآن الكريم يقيم جلسة حوارية لطلبة جامعة الكوفة
|
|
|