


 علم الكيمياء
علم الكيمياء 
 الكيمياء التحليلية
الكيمياء التحليلية 
 الكيمياء الحياتية
الكيمياء الحياتية 
 الكيمياء العضوية
الكيمياء العضوية 
 الكيمياء الفيزيائية
الكيمياء الفيزيائية
 الكيمياء اللاعضوية
الكيمياء اللاعضوية 
 مواضيع اخرى في الكيمياء
مواضيع اخرى في الكيمياء
 الكيمياء الصناعية
الكيمياء الصناعية |
أقرأ أيضاً
التاريخ: 15-10-2019
التاريخ: 6-12-2016
التاريخ: 2023-09-11
التاريخ: 17-10-2020
|
ولغرض توضيح ظاهرة الأنداد الضوئية يجب أن نرجع إلى الصيغة الهرمية لذرة الكاربون فإذا أتصلت ذرة الكاربون بأربع مجموعات مختلفة تكون ذرة كيرالية وتميز بوضع نجمة عليها فمثلا ذرة الكاربون رقم (2) في مركب 2- ميثيل - 1 - بيوتانول تعد كيرالية ( مركز عدم التناظر ) فهي تتصل بالمجموعات هيدروكسيل ، هيدروجين ، ميثيل وايثيل وهكذا بقية المركبات المذكورة معه .
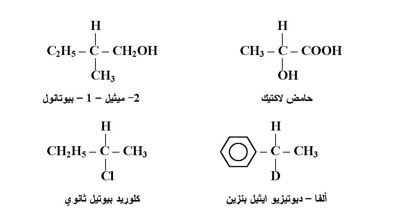
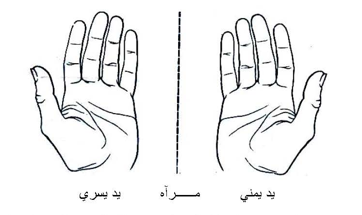
وحيث أن وصف كيرالي مشتق من معنى يوناني يرتبط باليد ولأن علاقة الند للآخر كعلاقة اليد اليمنى باليسرى فقد وصفت هذه المشكلات بأنها كيرالية 0 فحين ننظر إلى صورة اليد اليمنى في المرآة فإن ما نشاهده هو يد يسرى كما بالشكل التالي إضافة إلى اليد اليمنى لا تتطابق مع اليد اليسرى .
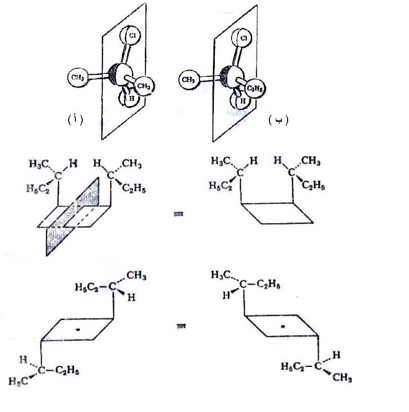
ويمكن توضيح كيرالية الجزئيات من خلال الرجوع إلى مركب 2 - بيوتانول المشار إليه آنفاً ، فإذا صنعنا نموذجاً مجسماً لهذا المركب لنعطي للمجموعات المختلفة ألواناً مختلفة لوجدنا أن هذا المركب يملك ندين مختلفين بالشكل التالي ولغرض توضيح ذلك يرمز لذرة الكاربون الكيرالية بدائرة وسطية مركزها ينطبق مع مركز الهرم الرباعي لذرة الكاربون .
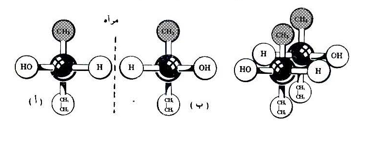
فإذا وضعنا النموذج (أ) أمام مرآة مستوية فإننا سوف نلاحظ صورة النموذج (ب) والعكس صحيح ، وحيث أن نموذجي (أ) و (ب) ليسا متطابقين وهما كالجسم وصورته في المرآة لذلك فهما يمثلان أشكال ابنانتيوميرية أو ما يسمى بالأنداد وبصورة مبسطة يمكن القول أن لكل جزئ فيه ذرة كاربون كيرالية واحدة يمكن أن يرسم ندان له في حين إذا تشابه مجموعتان أو أكثر على أية ذرة من ذرات الكاربون لأي مركب فإن الجزئ سوف يكون غير كيرالي أي متطابقاً مع صورته في المرآة ، ولغرض توضيح ذلك تصور المركب 2- بروبانول (2-8) الحاوي على مجموعتي ميثيل متصلة بالذرة المركزية محاولاً كتابة الأنداد الافتراضية له كما بالشكل التالي :
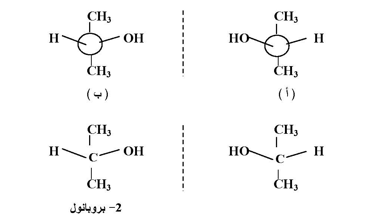
وعند النظر إلى الأشكال الافتراضية المرسومة في الشكل السابق لوجدنا أنهما يكونان متطابقين عند دوران أحدهما بزاوية مقدارها 180 لذلك فأنهما لا يعدان أندادا ضوئية بل يمثلان جزيئيتين لنفس المركب وأن هذا يعزز الحقيقة السابقة وهي أن كل مركب يحتوي على مركز كيرالي أو أكثر يمكن أن يوجد بأنداد مختلفة تعتمد على عدد المراكز الكيرالية.
لذلك فإن المقياس الأساسي للكيرالية هو أن الجزي وصورته في المرأة لا يتطابقان غير أن هناك طرقا أخرى يمكن بوساطتها التعرف على الكيرالية فمن هذه الطرق هي عدم وجود مستوى أو مركز أو محور تماثل للجزي فالجزي لا يكون كيرالياً إذا كان يملك مستوى تماثل أو مركز تماثل ويمكن تعريف مستوى التماثل بأنه مستوى تخيلي يقسم الجزي إلى قسمين متساويين أحدهما صورة مرآة للأخر فمثلا يملك المركب 2 - كلورو
(جـ)
ومستوى تماثل لذلك لا يعد نشطا ضوئيا ( أي لا يمكن رسم الأنداد الضوئية له ) بينما لا يملك 2- كلورو بيونان مثل هذا المستوى لذلك يعد نشطاً ضوئيا أيما يمكن رسم الأنداد الضوئية له ) الشكل ج –
لقد اقتصر حديثنا حتى الآن على جزئيات تحتوي على ذرة كاربون كيرالية واحدة وحيث أن هناك عدد كبيرا من الجزيئيات التي تحتوي على أكثر من مركز كيرالي والتي لا يمكن تطبيق القواعد المشار إليها آنفا لمعرفة فعاليتها تجاه الضوء المستقطب لذلك تم وضع وسائل أكثر سهولة لعرض تحديد هذه الفعالية التي من ضمنها صيغة مسقط فيشر .
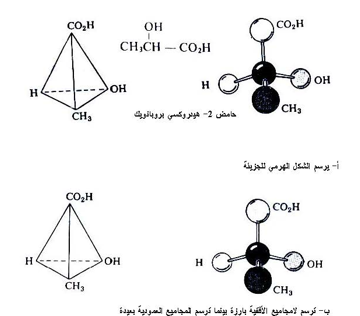
فلقد وضع أيميل فيشر طريقة مفيدة في تمثيل تراكيب كهذه بأبعاد ثنائية يعد أولاً أن الجزيء كله يحوي على مركز واحد غير متمائل ثم ترسم المجاميع الأفقية بارزة أي تشير نحو الناضر بينما ترسم المجاميع العمودية بعيدة عنه ثم تحول هذه الصيغة إلى صيغة فيشر ، فمثلا لو طلب منك رسم صيغة فيشر لحامض 2- هيدروكسي بروبانويك الشكل التالي :
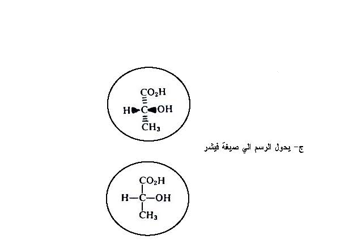
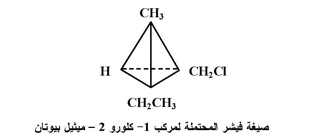
وتطبق القواعد نفسها عند رسم صيغ فيشر لجزيئات تحتوي على أكثر من مركز كيرالي وبصورة مبسطة فإن صيغة تستعمل لتمثيل المركب بخطوط تتقاطع عموديا حيث يمثل مركز التقاطع ذرة الكاربون الكيرالية فمثلا يمكن رسم المركب 1- كلورو -2 ميثيل بيوتان على الشكل التالي آخذين بنظر الاعتبار أن ذرة الكاربون
رقم ( 2 ) هي ذرة كيرالية .
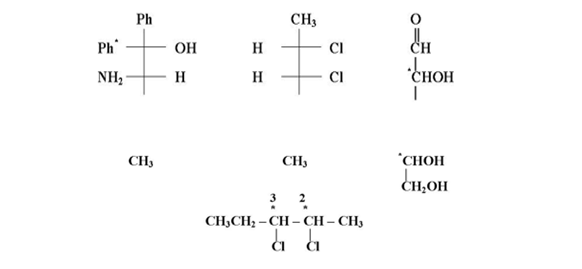
أن هذه الأشكال يمكن تدويرها ضمن مستوى الورقة أو السبورة لغرض معرفة تناضرها شرط أن لا ترفع عن مستواها أثناء التدوير



|
|
|
|
"عادة ليلية" قد تكون المفتاح للوقاية من الخرف
|
|
|
|
|
|
|
ممتص الصدمات: طريقة عمله وأهميته وأبرز علامات تلفه
|
|
|
|
|
|
|
ندوات وأنشطة قرآنية مختلفة يقيمها المجمَع العلمي في محافظتي النجف وكربلاء
|
|
|