
تاريخ الفيزياء

علماء الفيزياء


الفيزياء الكلاسيكية

الميكانيك

الديناميكا الحرارية


الكهربائية والمغناطيسية

الكهربائية

المغناطيسية

الكهرومغناطيسية


علم البصريات

تاريخ علم البصريات

الضوء

مواضيع عامة في علم البصريات

الصوت


الفيزياء الحديثة


النظرية النسبية

النظرية النسبية الخاصة

النظرية النسبية العامة

مواضيع عامة في النظرية النسبية

ميكانيكا الكم

الفيزياء الذرية

الفيزياء الجزيئية


الفيزياء النووية

مواضيع عامة في الفيزياء النووية

النشاط الاشعاعي


فيزياء الحالة الصلبة

الموصلات

أشباه الموصلات

العوازل

مواضيع عامة في الفيزياء الصلبة

فيزياء الجوامد


الليزر

أنواع الليزر

بعض تطبيقات الليزر

مواضيع عامة في الليزر


علم الفلك

تاريخ وعلماء علم الفلك

الثقوب السوداء


المجموعة الشمسية

الشمس

كوكب عطارد

كوكب الزهرة

كوكب الأرض

كوكب المريخ

كوكب المشتري

كوكب زحل

كوكب أورانوس

كوكب نبتون

كوكب بلوتو

القمر

كواكب ومواضيع اخرى

مواضيع عامة في علم الفلك

النجوم

البلازما

الألكترونيات

خواص المادة


الطاقة البديلة

الطاقة الشمسية

مواضيع عامة في الطاقة البديلة

المد والجزر

فيزياء الجسيمات


الفيزياء والعلوم الأخرى

الفيزياء الكيميائية

الفيزياء الرياضية

الفيزياء الحيوية

الفيزياء العامة


مواضيع عامة في الفيزياء

تجارب فيزيائية

مصطلحات وتعاريف فيزيائية

وحدات القياس الفيزيائية

طرائف الفيزياء

مواضيع اخرى
مفهوم الذرة Atom concept))
المؤلف:
أ.د. محمود محمد سليم صالح
المصدر:
تقنية النانو وعصر علمي جديد
الجزء والصفحة:
ص19–20، 21
2023-07-20
2404
الذرة هي مجموعة من الجسيمات المتناهية في الدقة وهذه الجسيمات تتكون من نواة موجبة الشحنة، وتحتوي في الغالب على البروتونات (موجبة الشحنة)، والنيترونات (المتعادلة). كما يوجد أيضًا عدد من الإلكترونات (سالبة الشحنة) التي تعادل الشحنة الموجبة في النواة (انظر: الشكل رقم 1). وتدور الإلكترونات في مستويات مختلفة تعرف بمستويات الطاقة، حيث يحمل المستوى الأول إلكترونين فقط، في حين يحمل المستوى الثاني ثمانية إلكترونات (انظر الشكل رقم 2)، أما المستوى الثالث فهو يحمل 18 إلكترونا. ولكل مستوى طاقة أساسي، مستويات فرعية يرمز لها بالرموز s،p،d،f (انظر: الشكل رقم 3). وتكون الذرات في الغالب متعادلة كهربيًّا؛ لأن عدد الإلكترونات السالبة يساوي عدد البروتونات الموجبة، ويمكن للذرة أن تتحول إلى أيون موجب، وذلك عندما تفقد إلكترونًا أو أكثر عند التفاعل الكيميائي، كما يمكن أن تتحول إلى أيون سالب، وذلك عندما تكتسب إلكترونًا أو أكثر، وذلك بحسب قيمة الشحنة التي تفقدها أو تكتسبها.
ونذكر بعض المفاهيم الأساسية التي يفترض إدراكها وفهمها لدى القارئ الكريم:
1 - تتكون المادة من وحدات بناء أساسية تسمى الذرات.
2- التركيب الذري للمادة له دور أساس في تحديد خصائص المادة.
3- تتكون الذرة من نواة موجبة الشحنة (بداخلها البروتونات الموجبة والنيوترونات المتعادلة)، وتحيط بها جسيمات سالبة الشحنة تسمى الإلكترونات.
4- تتوزع الإلكترونات حول النواة في مستويات طاقة محددة، وتعتمد قوة ارتباط الإلكترونات في مستويات الطاقة على بعدها عن النواة.
5- تسمى الإلكترونات الموجودة في مستويات الطاقة الأخيرة إلكترونات التكافؤ.
6- يمكن لبعض الإلكترونات الموجودة في مستوى الطاقة الأخير لبعض الذرات أن تتحرر نظرا لضعف ارتباطها بالنواة.
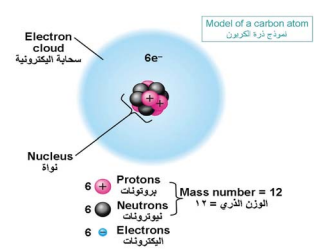
شكل رقم (1) أنموذج ذرة الكاربون.
شكل رقم (2) الالكترونات حول النواة لذرة الكاربون.
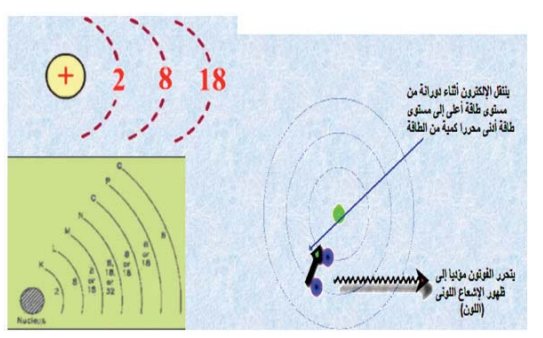
شكل رقم (3) توزيع الالكترونات في مستويات الطاقة.
 الاكثر قراءة في الفيزياء الذرية
الاكثر قراءة في الفيزياء الذرية
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة

الآخبار الصحية















 قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة
قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة "المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة
"المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة (نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)
(نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)


















