
تاريخ الفيزياء

علماء الفيزياء


الفيزياء الكلاسيكية

الميكانيك

الديناميكا الحرارية


الكهربائية والمغناطيسية

الكهربائية

المغناطيسية

الكهرومغناطيسية


علم البصريات

تاريخ علم البصريات

الضوء

مواضيع عامة في علم البصريات

الصوت


الفيزياء الحديثة


النظرية النسبية

النظرية النسبية الخاصة

النظرية النسبية العامة

مواضيع عامة في النظرية النسبية

ميكانيكا الكم

الفيزياء الذرية

الفيزياء الجزيئية


الفيزياء النووية

مواضيع عامة في الفيزياء النووية

النشاط الاشعاعي


فيزياء الحالة الصلبة

الموصلات

أشباه الموصلات

العوازل

مواضيع عامة في الفيزياء الصلبة

فيزياء الجوامد


الليزر

أنواع الليزر

بعض تطبيقات الليزر

مواضيع عامة في الليزر


علم الفلك

تاريخ وعلماء علم الفلك

الثقوب السوداء


المجموعة الشمسية

الشمس

كوكب عطارد

كوكب الزهرة

كوكب الأرض

كوكب المريخ

كوكب المشتري

كوكب زحل

كوكب أورانوس

كوكب نبتون

كوكب بلوتو

القمر

كواكب ومواضيع اخرى

مواضيع عامة في علم الفلك

النجوم

البلازما

الألكترونيات

خواص المادة


الطاقة البديلة

الطاقة الشمسية

مواضيع عامة في الطاقة البديلة

المد والجزر

فيزياء الجسيمات


الفيزياء والعلوم الأخرى

الفيزياء الكيميائية

الفيزياء الرياضية

الفيزياء الحيوية

الفيزياء والفلسفة

الفيزياء العامة


مواضيع عامة في الفيزياء

تجارب فيزيائية

مصطلحات وتعاريف فيزيائية

وحدات القياس الفيزيائية

طرائف الفيزياء

مواضيع اخرى
انتقال الحرارة والحرارتان النوعيتان للغازات المثالية
المؤلف:
فريدريك بوش ، دافيد جيرد
المصدر:
اساسيات الفيزياء
الجزء والصفحة:
ص 447
30-6-2016
4721
انتقال الحرارة والحرارتان النوعيتان للغازات المثالية
تعتمد كمية الحرارة المنتقلة إلى الغاز أو منه ، كالشغل تماماً، على تفاصيل العملية المستخدمة. (ولهذا فإن Q ليست دالة حالة للنظام ). وهناك نوعان من العمليات التي يمكن فيهما حساب الانتقال الحراري مباشرة بمنتهى السهولة وهما: العمليات ثابتة الحجم والعمليات ثابتة الضغط .
العمليات ثابتة الحجم
عندما تضاف الحرارة إلى غاز مع حفظ حجمه ثابتاً يكون الشغل المبذول صفراً (لأن V = 0Δ) ويخبرنا القانون الأول للديناميكا الحرارة أن الحرارة المضافة في هذه الحالة تستهلك في زيادة الطاقة الحرارية:
(1) Q = ΔU (عند ثبوت الحجم)
أن العلاقة بين ΔU و ΔT في حالة الغازات أحادية الذرة تكون على الصورة ΔU = ½ nRΔT وعليه، يمكننا تمثيل العلاقة بين الحرارة المنتقلة إلى الغاز Q والتغير الناتج في درجة حرارته ΔT بالمعادلة:

حتى هذه النقطة لم تتعرف إلى على كمية واحدة تربط بين كمية الحرارة Q والتغير الناتج في درجة الحرارة TΔ لكمية معينة من المادة ، وهذه الكمية هي الحرارة النوعية للمادة c = Q/m ΔT، حيث m كتلة العينة. ولكن كمية المادة تقاس عادة في حالة الغازات بالمولات. ومن ثم يمكننا تعريف الحرارة النوعية الجزيئية (او المولارية) C كالتالي:
(2) 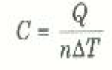
حيث n عدد الملات من الغاز. وحيث ان هذه النسبة تعتمد على نوع عملية الانتقال الحراري، علينا تمييز C يرمز مناسب يشير إلى العملية التي تتحدث عنها. ولذلك فإننا سنستخدم الرمز Cv في حالة العمليات ثابتة الحجم.
نجد أن3/2 nRΔT Q =، وبالتعويض من هذه العلاقة الأخيرة في المعادلة (2) سنحصل على العلاقة البسيطة الآتية:

أما في حالة الجزيئات الاكثر تعقيداً فإن نفس الطريقة تعطينا النتيجة العامة الآتية:
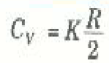
حيث K عدد صحيح.
العمليات ثابتة الضغط
أن W = P ΔV في العملية ثابتة الضغط، وبناء على ذلك يمكن كتابة القانون الأول في هذه الحالة على الصورة:
( 3أ) 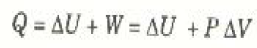
وعندما يكون P ثابتاً فإن قانون الغاز المثالي يعطينا:
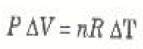
وعليه فإن:
( 3ب) 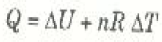
أنCV ، تعرف الحرارة النوعية الجزيئية عند ثبوت الضغط CP كالتالي:
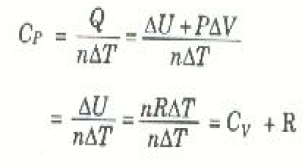
وحيث أن هذه النتيجة لا تعتمد على نوع الغاز، إذن:
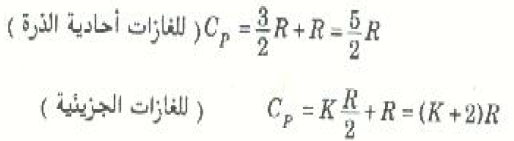
ليس من الغريب أن تكون CP أكبر دائماً من CV. فعند ثبوت يستهلك بعض الحرارة في بذل الشغل الخارجي، ويستهلك الجزء الباقي في زيادة الطاقة الداخلية، أي في رفع درجة الحرارة. إذن، كلما كانت الحرارة النوعية كبيرة، كلما قل التغير في درجة الحرارة لنفس كمية الحرارة المنتقلة.
يرمز للنسبة بين الحرارتين النوعيتين في هاتين العمليتين بالرمز γ، أي أن :
(4) 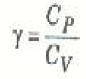
الجدول (1) : الحرارة النوعية الجزيئية والكتلية للغازات
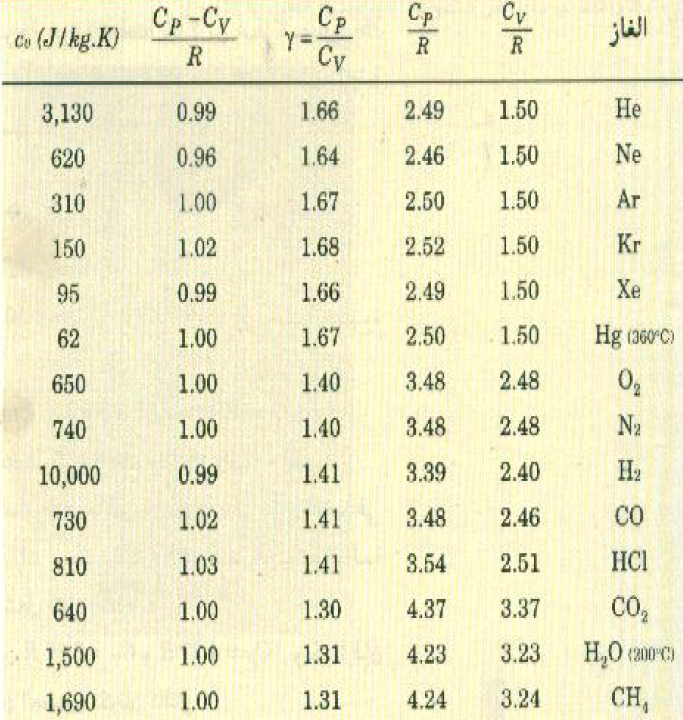
عند درجة 15oC لجميع الغازات ما لم ينص على غير ذلك.
يمثل الجدول ((1 القيم المقاسة عملياً للحرارتين النوعيتين CP و CV والنسبة بينمها Y لعدد من الغازات. لاحظ أن γ = 1.67 للغازات أحادية الذرة، كذلك فإن قيم γ للغازات الأخرى يمكن استخدامها لحساب قيمة K لكل غاز ، إذ أن معادلاتنا السابقة تبين أن (K + 2)/K = γ ففي حالة الغازات ثنائية الذرة يلاحظ من الجدول أن 1.40= 7/5=γ، وهذا يعني أن K = 5. ام بالنسبة للجزيئات المركبة فإن=1.3=4/3γ. وهذه القيمة بالنسبة y تناظر K = 6. نستنتج من ذلك إذن أن التجربة تؤيده ما توقعناه سابقاً بأن k عدد صحيح.
وكاختيار آخر لصحة المعادلات السابق اشتقاقها للحرارتين النوعيتين للغازات يمكننا استخدام العلاقة الآتية:
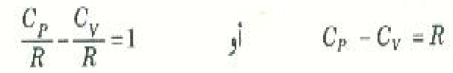
وبالرجوع إلى العمود قبل الأخير في الجدول ((1 سنجد أن هذا صحيح لجميع الغازات.
 الاكثر قراءة في الديناميكا الحرارية
الاكثر قراءة في الديناميكا الحرارية
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة

الآخبار الصحية















 قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة
قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة "المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة
"المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة (نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)
(نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)


















