
القانون الأول للديناميكا الحرارية
 المؤلف:
بيتر أتكينز
المؤلف:
بيتر أتكينز
 المصدر:
الكيمياء الفيزيائية
المصدر:
الكيمياء الفيزيائية
 الجزء والصفحة:
ص 31 – ص 34
الجزء والصفحة:
ص 31 – ص 34
 2024-10-01
2024-10-01
 2013
2013
من منظور علماء الكيمياء الفيزيائية، يُعد القانون الأول إسهابًا على ما جاء في «قانون حفظ الطاقة» الذي ينص على أن الطاقة لا تفنى ولا تُستحدث من العدم. فهو يوضح أن الديناميكا الحرارية تشمل انتقال الطاقة على هيئة حرارة، في حين أن ديناميكا نيوتن وتلامذته لا تشمل ذلك. ويُعد المفهوم المحوري للقانون الأول هو «الطاقة الداخلية»، والتي يرمز لها بـ U ويقصد بها الطاقة الإجمالية المنبعثة من أية منطقة في العالم تخضع للدراسة من جانبنا، أي، «النظام»؛ ولكن ذلك لا يتضمن الطاقة المنبعثة نتيجة لمسببات خارجية، مثل حركة النظام بأكمله عبر الحيز المكاني. وقد أثبتت التجارب التفصيلية التي أجراها جيمس جول (1818–1889) في منتصف القرن التاسع عشر أن الطاقة الداخلية لنظام ما قد تتغير من خلال بذل شغل أو تسخين النظام. وينطوي الشغل، وهو مفهوم مأخوذ من الديناميكا على التحرك ضد قوة معاكسة، أما الحرارة، وهو مفهوم جديد في الديناميكا الحرارية، فهي عبارة عن انتقال الطاقة التي تستغل الاختلاف في درجة الحرارة. إن فشل عدد لا يُحصى من المحاولات – حسنة النية عادة ولكنها مدفوعة بالجشع والنصب والاحتيال كذلك – لابتكار آلة الحركة الأبدية – وهي عبارة عن آلة يمكنها إنتاج شغل بدون أي مدخلات للطاقة (كالحرارة) – أدى في النهاية إلى استنتاج مفاده أن «الطاقة الداخلية لنظام معزول عن التأثيرات الخارجية لا تتغير». وهذا هو القانون الأول للديناميكا الحرارية.
ويتعين علي هنا أن أدلي بملاحظة. لأي نظام طاقة، ولكن ليس بالضرورة أن يكون له شغل أو حرارة (حتى وإن كان ساخنًا). ويُعد الشغل والحرارة شكلين مختلفين من «انتقال» الطاقة داخل النظام أو خارجه والشغل هو شكل من أشكال انتقال الطاقة يعادله رفع الأثقال، أما الحرارة، فهي شكل من أشكال انتقال الطاقة ينتج عن الاختلاف في درجة الحرارة (انظر شكل 2–1). وعندما نقول إن «النظام ساخن»، لا نعني بذلك أنه يملك الكثير من الحرارة؛ وإنما يحظى بدرجة حرارة عالية بسبب الطاقة التي يختزنها حاليًّا.
لأسباب عملية في العديد من الحالات يولي علماء الكيمياء الفيزيائية اهتمامًا أقل بالطاقة الداخلية مقارنة بخاصية وثيقة الصلة تُسمى الإنثالبي (المحتوى الحراري)، ويرمز له بـ H. والمقابل الإنجليزي لهذا المصطلح enthalpy مشتق من العبارة اليونانية التي تعني «الحرارة بالداخل»، وعلى الرغم من عدم وجود «حرارة» كهذه داخل أي نظام، فالاسم المستخدم صائب تمامًا، وسأشرح السبب بعد قليل.
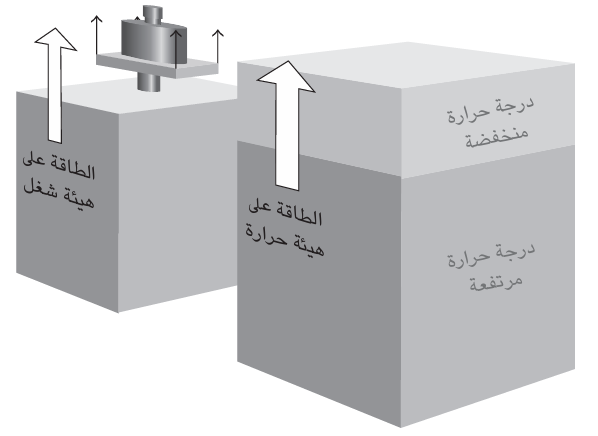
شكل 2–1: الشغل هو شكل من أشكال انتقال الطاقة يضاهيه رفع الأثقال، أما الحرارة فهي شكل من أشكال انتقال الطاقة ينتج عن الاختلاف في درجة الحرارة. ويزيد هذان الشكلان الطاقة الداخلية للنظام أو يقللانها.
ولكي تكتمل الفكرة وعلى الرغم من عدم أهمية ذلك لطرحنا النظري هنا، إذا عرفت الطاقة الداخلية لنظام ما، يمكنك ببساطة أن تحسب الإنثالبي الخاص به من خلال جمع حاصل ضرب ضغط النظام في حجمه pV والطاقة الداخلية (H = U + pV) U. والنقطة المهمة هنا تكمن في أن أهمية الإنثالبي تتمثل في أن التغير في قيمته مكافئ لخرج الطاقة على هيئة حرارة الذي يمكن استخلاصه من النظام شريطة أن يظل تحت ضغط ثابت. فعلى سبيل المثال، إذا تراجع الإنثالبي الخاص بالنظام بمقدار 100 جول عندما يخضع لتغير معين (مثل تفاعل كيميائي)، إذن فنحن نعرف أنه يمكن استخلاص 100 جول من الطاقة على هيئة حرارة، بشرط أن يكون الضغط ثابتًا.
وتكمن العلاقة بين التغيرات في الإنثالبي والخرج الحراري في صميم الكيمياء الفيزيائية، أو هي بالأحرى جوهر الديناميكا الحرارية الكيميائية، المعروفة باسم «الكيمياء الحرارية»، والتي تدرس عمليات الانتقال الحراري المصاحبة للتفاعلات الكيميائية. وهذا الجانب من الكيمياء ذو أهمية حيوية أينما تُستخدم أنواع الوقود، حيث لا تشمل أنواع الوقود بنزين محركات الاحتراق الداخلي فحسب، وإنما أيضًا الأطعمة التي تمد الكائنات الحية بالطاقة. وفي هذا الاستخدام الأخير، فإن دور استخدام الطاقة في الكائنات الحية يدرسه علم «الطاقة الحيوية»، وهو قسم فرعي للكيمياء الحرارية يركز على العمليات الكيميائية الحيوية.
والأداة الرئيسية التي يستخدمها علماء الكيمياء الحرارية هو «المسعر الحراري»، وهو بالأساس عبارة عن وعاء مزود بترمومتر؛ إلا أنه طُور إلى حد كبير، مثل الكثير من الأجهزة العلمية، ليصبح أداة متقدمة عالية الدقة خاضعة للتحكم والتحليل من قبل جهاز كمبيوتر. وبشكل عام، يُسمح بحدوث التفاعل الكيميائي المعني بالدراسة في الوعاء ويُسجل الارتفاع الناتج في درجة الحرارة. ويحول هذا الارتفاع (أو الانخفاض في بعض الحالات النادرة) في درجة الحرارة بعد ذلك إلى خرج حراري من خلال مقارنته بتفاعل معروف مسبقًا أو التأثير الخاص بالتسخين الكهربائي. وإذا كان المسعر الحراري معرضًا للأجواء المحيطة (وبالتالي معرضًا لضغط ثابت) حينئذٍ يكون الخرج الحراري مكافئًا للتغير في الإنثالبي الخاص بمزيج التفاعل وحتى وإن كان وعاء التفاعل محكم الإغلاق ومحتوياته خاضعة للتغير في الضغط ، لدى الكيميائيين وسائل لتحويل البيانات إلى ظروف ذات ضغط ثابت، ويمكنهم استنباط التغير في الإنثالبي من التغير الملاحظ في درجة الحرارة.
واعتمادًا على القانون الأول للديناميكا الحرارية، يدرك علماء الكيمياء الحرارية بشيء من الارتياح أنهم ليسوا مضطرين إلى إخضاع كل تفاعل متخيل إلى الدراسة والفحص. وربما يُنظر إلى التفاعل الكيميائي محل الاهتمام بأنه يحدث عبر سلسلة من الخطوات التي خضعت بالفعل للدراسة. ووفقًا للقانون الأول للديناميكا الحرارية، يجب أن يكون التغير في الإنثالبي باستخدام المسار المباشر مساويًا لمجموع التغيرات في الإنثالبي باستخدام المسار غير المباشر مثلما يتعين على مسارين أعلى جبل واقعين بين نفس النقطتين أن يؤديا إلى التغير نفسه في الارتفاع عن سطح البحر)؛ وإلا فستكون لديك نظريا طريقة لاستحداث الطاقة: البدء بمركب ما ؛ ثم تغييره؛ وبعد ذلك إعادته إلى المركب الأصلي مرة أخرى من خلال مسار مختلف واستخلاص الفارق في الطاقة. ومن ثم، يمكنهم جدولة البيانات التي يمكن استخدامها لتوقع التغييرات الطارئة على الإنثالبي في أي تفاعل کيميائي محل اهتمام بالنسبة إليهم . على سبيل المثال، إذا كان تغيرا الإنثالبي للتفاعلين B → C و A → B معروفين، فإن التغير الخاص بالتفاعل A → C هو عبارة عن مجموعهما. (ولا يقيد علماء الكيمياء الفيزيائية أنفسهم بتفاعلات محددة؛ وهو ما يعرضهم للسخرية اللطيفة من جانب علماء الكيمياء العضوية والكيمياء غير العضوية. ويجادلون بأنه من أجل الحفاظ على مبدأ التعميم يستخدمون الرموز A وB وC ؛ وهو ما يجعل زملاءهم المتشككين عادة ما يرتابون بسخرية في أن مثل هذا التعميم يخفي وراءه في الحقيقة جهلًا.)
وفي الأيام الأولى للكيمياء الفيزيائية (وأقصد هنا القرن العشرين)، كانت تغيرات الإنثالبي تُقدر عادة من خلال ملاحظة أي من هذه الروابط تكسر في المواد المتفاعلة وأي منها تتكون لصنع النواتج، وبالتالي ربما تكون A → B خطوة كسر الرابطة وB → C خطوة تكوين الرابطة الجديدة، والتي يُحسب تغيرات الإنثالبي الخاصة بكل منهما بمعلومية قوة الروابط القديمة والجديدة. وكثيرًا ما كان يعطي هذا الإجراء، رغم أنه إجراء مفيد بوجه عام، نتائج غير دقيقة على نحو كبير، لأن الروابط كيانات حساسة ذات قوى تعتمد على ماهية الذرات الأخرى الموجودة في الجزيئات ومواضعها. والآن، تلعب الحوسبة دورا مركزيا: صار الآن شيئًا عاديًا أن يُحسب الفارق في الطاقة بين النواتج والمواد المتفاعلة؛ لا سيما إذا كانت الجزيئات معزولة كما في الحالة الغازية، وهذا الفارق يتحول بسهولة إلى تغير في الإنثالبي إلا أن الحوسبة أقل موثوقية فيما يخص التفاعلات الكيميائية الخاصة بالسوائل أو المحاليل ولا يزال هناك شوطًا لنقطعه على طريق التقدم في هذا الصدد.
هذا، وتُعد التغيرات في الإنثالبي مهمة جدًّا من أجل إجراء مناقشة منطقية للتغيرات الطارئة على الحالة الفيزيائية (التبخر والتجمد على سبيل المثال) وهي أيضًا للتطبيقات الخاصة بالقانون الثاني للديناميكا الحيوية.
 الاكثر قراءة في الديناميكا الحرارية
الاكثر قراءة في الديناميكا الحرارية
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة


