
تاريخ الفيزياء

علماء الفيزياء


الفيزياء الكلاسيكية

الميكانيك

الديناميكا الحرارية


الكهربائية والمغناطيسية

الكهربائية

المغناطيسية

الكهرومغناطيسية


علم البصريات

تاريخ علم البصريات

الضوء

مواضيع عامة في علم البصريات

الصوت


الفيزياء الحديثة


النظرية النسبية

النظرية النسبية الخاصة

النظرية النسبية العامة

مواضيع عامة في النظرية النسبية

ميكانيكا الكم

الفيزياء الذرية

الفيزياء الجزيئية


الفيزياء النووية

مواضيع عامة في الفيزياء النووية

النشاط الاشعاعي


فيزياء الحالة الصلبة

الموصلات

أشباه الموصلات

العوازل

مواضيع عامة في الفيزياء الصلبة

فيزياء الجوامد


الليزر

أنواع الليزر

بعض تطبيقات الليزر

مواضيع عامة في الليزر


علم الفلك

تاريخ وعلماء علم الفلك

الثقوب السوداء


المجموعة الشمسية

الشمس

كوكب عطارد

كوكب الزهرة

كوكب الأرض

كوكب المريخ

كوكب المشتري

كوكب زحل

كوكب أورانوس

كوكب نبتون

كوكب بلوتو

القمر

كواكب ومواضيع اخرى

مواضيع عامة في علم الفلك

النجوم

البلازما

الألكترونيات

خواص المادة


الطاقة البديلة

الطاقة الشمسية

مواضيع عامة في الطاقة البديلة

المد والجزر

فيزياء الجسيمات


الفيزياء والعلوم الأخرى

الفيزياء الكيميائية

الفيزياء الرياضية

الفيزياء الحيوية

الفيزياء العامة


مواضيع عامة في الفيزياء

تجارب فيزيائية

مصطلحات وتعاريف فيزيائية

وحدات القياس الفيزيائية

طرائف الفيزياء

مواضيع اخرى
البنية الإلكترونية للذرات
المؤلف:
بيتر أتكينز
المصدر:
الكيمياء الفيزيائية
الجزء والصفحة:
ص 11 – ص 15
2024-10-01
2049
يولي علماء الكيمياء الفيزيائية اهتمامًا كبيرًا للإلكترونات التي تحيط بنواة الذرة: فهنا يحدث النشاط الكيميائي ويعبر العنصر عن هويته الكيميائية والنقطة المهمة التي يجب علينا تذكرها في هذا المقام هي أن عدد الإلكترونات في الذَّرَّة مماثل لعدد البروتونات في النواة. والشحنة الكهربائية للإلكترونات والبروتونات لها نفس المقدار ولكنها متضادة، ومن ثم فإن تلك المساواة في العدد تضمن أن تكون الذَّرَّة في المجمل متعادلة كهربائيا. لذا، فإن لذرة الهيدروجين إلكتروناً واحدًا حول نواتها، ولذَرَّة الهيليوم إلكترونين، ولذرة الليفر موريوم 118 إلكترونا، وهلم جرا.
وتلعب ميكانيكا الكم دورًا محوريا في تفسير توزيع الإلكترونات حول النواة. ويُعد «نموذج بور» المبكر للذَّرَّة – وهو النموذج الذي اقترحه نيلز بور (1885–1962) في عام 1913، مفترضًا وجود إلكترونات في مدارات تحيط بالنواة ككواكب مصغرة والمستخدم على نطاق واسع في الرسومات المنتشرة لشكل الذرة – نموذجًا خاطئًا من جميع النواحي تقريبًا، إلا أنه من الصعب محوه من مخيلة العامة. ويرى تصور ميكانيكا الكم للذرات أنه لا يمكن تحديد مسار محدد حول النواة ليدور فيه الإلكترون، وأن «المدارات» الكوكبية الخاصة بنظرية بور غير موجودة ببساطة، وأن بعض الإلكترونات لا تدور حول النواة من الأساس.
يستند فهم علماء الكيمياء الفيزيائية للبنى الإلكترونية الخاصة بالذرات إلى نموذج شرودنجر لذرة الهيدروجين، الذي وضعه في عام 1926 كان إرفين شرودنجر (1887– 1961) أحد مؤسسي علم ميكانيكا الكم، وفي إحدى النزوات الشهوانية – على حد وصفه – أثناء قضاء إجازة مع إحدى عشيقاته، وضع المعادلة التي تحمل اسمه وحل لغز موقع الإلكترون في ذَرَّة الهيدروجين. فبدلا من نموذج المدارات، وجد أنه يمكن للإلكترون أن يتخذ واحدة من عدة توزيعات متنوعة أشبه بالموجة حول النواة، تُسمى «دوال موجية»، وكل موجة تتوافق مع مستوى معين من الطاقة.
استخدم علماء الكيمياء الفيزيائية حلول شرودنجر لذرة الهيدروجين واتخذوا منها نقطة انطلاق لنقاشهم حول ذَرَّات جميع العناصر. وهذا هو أحد الأسباب التي جعلت ذَرَّة الهيدروجين محورية جدًّا لفهمهم الكيمياء. وهم يطلقون على التوزيعات الإلكترونية الشبيهة بالموجات المدارات الذرية»، مما يشير إلى وجود صلة ما بمدارات بور إلا أنها تشير إلى شيء أقل تحديدًا من المسار الفعلي للإلكترونات.
ينبغي علينا استخدام بعض المصطلحات هنا. يُعد المدار الذَّرِّي الأقل طاقة في ذرة الهيدروجين مثالاً على «المدار s». ويمكن تخيل الإلكترون في المدار s (يستخدم علماء الكيمياء الفيزيائية كلمة «في» عندما يقصدون توزيعا يوضحه مدار معين) على هيئة توزيع كروي الشكل شبيه بالسحابة أكثر سمكًا عند النواة ويتناقص هذا السمك بشدة مع الابتعاد عنها (انظر شكل 1–1). وهذا يعني أنه من المرجح أكثر العثور على الإلكترون عند النواة، ويقل هذا الترجيح تدريجيًّا عند نقاط تبتعد عنها بمسافة أكبر. بالمناسبة، لا يسعى الإلكترون في هذا النوع من المدارات للدوران حول النواة؛ وإنما في الواقع يحوم حولها ويحيط بها فحسب. وكثيرًا ما يُقال إن الذَّرَّة عبارة عن مساحة فارغة في أغلبها. وهذا ما تبقى من نموذج بور الذي يدور فيه الإلكترون الشبيه بالنقطة حول النواة؛ أما في نموذج شرودنجر، فلا توجد مساحة فارغة، وإنما ثمة احتمالات متفاوتة للعثور على الإلكترون في موقع محدد.
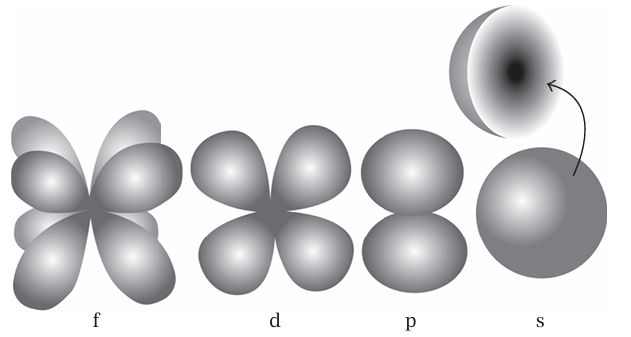
شكل 1–1: الأشكال الأساسية المدارات s وp وd وf. تحيط الحدود بالمناطق التي من المرجح أن يوجد فيها الإلكترون. يبين المقطع الداخلي البنية الداخلية لمدار s، بدرجات تظليل تمثل احتمالية إيجاد إلكترون عند كل موضع.
توجد مدارات أخرى من النوع s، لكل منها طاقة أعلى تباعًا، وكل منها يشكل غلافًا كرويا شبيهًا بالسحابة على مسافات أبعد تدريجيا من النواة. وهي تُسمى 1s (المدار s الأقل طاقة) و2s و 3s وهلم جرا. وفي ذرة الهيدروجين، يوجد الإلكترون الوحيد في المدار 1s.
كما توجد حلول موجية أخرى لمعادلة شرودنجر لذرة الهيدروجين (كما هو مبين في الشكل التوضيحي). فما يُطلق عليه «المدار p» هو عبارة عن تجمع من ساحبتين على طرفين متقابلين للنواة ، ويتكون «المدار d» من أربع مناطق شبيهة بالسحابة، و«المدار f» يتكون من ثماني مناطق مشابهة، وهلم جرا. وثمة نقطتان نود الإشارة إليهما في هذا المقام: أولا، الرموز s وp وd وf مستقاة من ملاحظات طيفية مبكرة جدا للذرات ولم يعد أصلها يمثل أية أهمية لأحد باستثناء مؤرخي العلوم؛ إلا أن الرموز ظلت قائمة وتعد جزءًا محورياً من المصطلحات التي يستخدمها كل الكيميائيين. ثانيًا، تتتابع الرموز وصولا إلى الحرفين g وh وما إلى ذلك ؛ ولكن لا يكاد الكيميائيون يتعاملون أبدًا مع هذه المدارات الأخرى، ولسنا بحاجة إلى الاستزادة في مناقشتها.
ومضى شرودنجر ليوضح أنه بينما توجد طريقة واحدة لإحاطة النواة بغلاف كروي (مما يؤدي إلى وجود مدار s واحد فقط عند أي مستوى من الطاقة)، توجد ثلاث طرق لإحاطة النواة بمدار p مما يؤدي إلى وجود ثلاثة مدارات p عند (أي مستوى من الطاقة). وعلى نحو مماثل، توجد خمس طرق لإحاطة النواة بمدار d الأكثر تعقيدًا (أي توجد خمسة مدارات d عند أي مستوى من الطاقة)، وتوجد سبع طرق لإحاطة النواة بمدار f. علاوة على ذلك، عند أي مستوى طاقة معين لا يمكن أن توجد سوى أنواع معينة من المدارات. ولذا، نجد أن النمط الفعلي كما يلي:
1s
2s 2p
3s 3p 3d
4s 4p 4d 4f
وهلم جرا، بحيث يعد 1s المدار الأقل طاقة.
وفي ذرة الهيدروجين، تحظى جميع المدارات الموجودة على المستوى نفسه (أي نفس الصف في هذه القائمة بالطاقة نفسها. وفي جميع الذرات الأخرى، حيث يوجد أكثر من إلكترون واحد، يعدِّل التنافر المتبادل بين الإلكترونات مستويات الطاقة، وتتغير القائمة بوجه عام إلى ما يلي:
1s
2s 2p
3s 3p
4s 3d 4p
مع ظهور المزيد من التغيرات المعقدة في المدارات الأخرى. وسأعقب بنقطتين في هذا الصدد.
أولًا، للكيمياء الفيزيائية تخصص فرعي يُعرف باسم «الكيمياء الحاسوبية». وكما يوحي اسمه، يستخدم هذا التخصص الفرعي أجهزة الكمبيوتر لحل معادلات شرودنجر في نُسخها الأكثر تعقيدًا والتي تنشأ عند التعامل مع الذرات والجزيئات. أركز هنا على المشكلة الأبسط كثيرًا للذرات المفردة، التي جرى التعامل معها بعد صياغة معادلة شرودنجر بفترة قصيرة جدا عن طريق القيام بعمليات حسابية يدوية بالغة التفصيل. الآن، صارت الذرات في جوهرها مشكلة تافهة بالنسبة إلى أجهزة الكمبيوتر الحديثة، وصارت تستخدم لصياغة توصيفات شديدة التفصيل لتوزيع الإلكترونات في الذرة ومستويات الطاقة المدارية. لكن على الرغم من أن علماء الكيمياء الفيزيائية يستطيعون الآن حساب الخواص الذرية بدقة كبيرة بضغطة زر واحدة تقريبًا، فإنه يروقهم وضع نماذج للذرات تمنحنا نظرة ثاقبة على بنيتها وتقدم لنا فهما بدلًا من مجرد سلسلة أرقام. ويُستعان بهذا الفهم بعد ذلك في الكيمياء غير العضوية والعضوية بالإضافة إلى أجزاء أخرى من الكيمياء الفيزيائية. لقد طورت النماذج بناءً على الطريقة التي يؤثر بها التنافر بين الإلكترونات الموجودة في ذرات عناصر أخرى غير الهيدروجين على مستويات الطاقة المدارية ونمط شغل الإلكترونات لهذه المدارات.
تقدم عبارة «نمط شغل الإلكترونات لهذه المدارات» مبدأ مهما آخر مأخوذا من الفيزياء. ففي عام 1925، وضع فولفجانج باولي ( 1900–1958) مبدأ مهما عندما صادف بعض السمات الغريبة الخاصة بالتحليل الطيفي للذرات؛ إذ لاحظ اختفاء ترددات معينة في الأطياف، واستنتج أن حالات معينة للذرة محظورة. وبعد أن صيغت قوانين ميكانيكا الكم، أدرك العلماء أن ثمة طريقة عميقة للتعبير عن مبدئه، والتي لن نستخدمها في هذا الكتاب، وأن ثمة طريقة مباشرة أكثر في هذا الشأن ستخدم أغراضنا هنا، وتُعرف بـ «مبدأ الاستبعاد لباولي»:
لا يمكن لأكثر من إلكترونين شغل أي مدار ، وإذا شغل إلكترونان ذلك المدار، يجب أن يلفا بشكل مغزلي في اتجاهين معاكسين.
سنستخدم تلك الصيغة من المبدأ، والتي تناسب الكثير من التطبيقات في الكيمياء الفيزيائية.
ينص المبدأ، في أبسط . صوره، على ألا تشغل جميع إلكترونات الذرة المدار 1s (باستثناء ذرة الهيدروجين التي تحتوي على إلكترون واحد فقط وذرة الهيليوم التي تحتوي على إلكترونين). على سبيل المثال، يحتوي الليثيوم على ثلاثة إلكترونات: اثنان منها تشغل المدار 1s، ولا يستطيع الإلكترون الثالث أن ينضم إليهما، ويجب أن يشغل المدار التالي ذا المستوى الأعلى من الطاقة، أي المدار 2s. مع أخذ هذه النقطة في الاعتبار، يتضح امامنا شيء رائع للغاية؛ تتكشف لنا بنية الجدول الدوري للعناصر، الذي يعد الأيقونة الرئيسية لعلم الكيمياء.
لنرى مثالًا عمليًّا على ذلك، تأمل الأحد عشر عنصرًا الأولى في الجدول الدوري، والتي تحتوي على إلكترون واحد وحتى 11 إلكتروناً ( عدد الإلكترونات مكتوب بين أقواس في هذه القائمة):
H[1] He[2]
Li[3] Be[4] B[5] C[6] N[7] O[8] F[9] Ne[10]
Na[11] ...
يمكن أن يشغل الإلكترون الأول المدار 1s، ويستطيع الإلكترون الثاني في عنصر الهيليوم (He) أن ينضم إليه. عند تلك النقطة، يمتلئ المدار بالإلكترونات، ويجب أن يشغل الإلكترون الثالث في عنصر الليثيوم (Li) المدار التالي الأعلى، أي المدار 2s. ويمكن للإلكترون التالي، لعنصر البيريليوم (Be)، أن ينضم إليه؛ وهكذا سيمتلئ بالإلكترونات. وعند هذه النقطة، يمكن للإلكترونات الستة التالية أن توزع بالتناوب على مدارات 2p الثلاثة. وبعد توزيع هذه الإلكترونات الستة (كما في عنصر النيون، Ne)، تكون المدارات 2p كلها قد امتلأت عن آخرها، ويجب على الإلكترون الحادي عشر، لعنصر الصوديوم (Na) أن ينتقل إلى المدار 3s وفي الوقت نفسه، يبدأ صف جديد من الجدول الدوري. وعلى الفور، يمكنك أن تلاحظ الآن السبب وراء تقارب الليثيوم والصوديوم واصطفافهما في نفس العمود («المجموعة») في الجدول الدوري؛ إذ يملك كل منهما إلكتروناً مفردًا في المدار s. ويسري منطق مشابه على جميع عناصر الجدول، حيث إن عناصر المجموعة نفسها تحظى جميعها بترتيبات إلكترونية متشابهة وكل صف («دورة») تال يمثل غلاف المدارات الخارجي التالي.
وعند هذا الموضع تتحول الكيمياء الفيزيائية إلى « كيمياء غير عضوية»، أي الكيمياء الخاصة بجميع العناصر. فالكيمياء الفيزيائية فسرت البنية العامة للجدول الدوري، أما الكيمياء غير العضوية فتستكشف العواقب ومن اللافت للانتباه، في رأيي، أن الأفكار البسيطة جدًّا حول وجود المدارات ومستويات الطاقة الخاصة بها، مقرونة بمبدأ يحكم شغلها، تفسر العلاقات بين العناصر ، كما يتضح من الجدول الدوري.
 الاكثر قراءة في الفيزياء الذرية
الاكثر قراءة في الفيزياء الذرية
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة

الآخبار الصحية















 قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة
قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة "المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة
"المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة (نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)
(نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)


















