
تاريخ الفيزياء

علماء الفيزياء


الفيزياء الكلاسيكية

الميكانيك

الديناميكا الحرارية


الكهربائية والمغناطيسية

الكهربائية

المغناطيسية

الكهرومغناطيسية


علم البصريات

تاريخ علم البصريات

الضوء

مواضيع عامة في علم البصريات

الصوت


الفيزياء الحديثة


النظرية النسبية

النظرية النسبية الخاصة

النظرية النسبية العامة

مواضيع عامة في النظرية النسبية

ميكانيكا الكم

الفيزياء الذرية

الفيزياء الجزيئية


الفيزياء النووية

مواضيع عامة في الفيزياء النووية

النشاط الاشعاعي


فيزياء الحالة الصلبة

الموصلات

أشباه الموصلات

العوازل

مواضيع عامة في الفيزياء الصلبة

فيزياء الجوامد


الليزر

أنواع الليزر

بعض تطبيقات الليزر

مواضيع عامة في الليزر


علم الفلك

تاريخ وعلماء علم الفلك

الثقوب السوداء


المجموعة الشمسية

الشمس

كوكب عطارد

كوكب الزهرة

كوكب الأرض

كوكب المريخ

كوكب المشتري

كوكب زحل

كوكب أورانوس

كوكب نبتون

كوكب بلوتو

القمر

كواكب ومواضيع اخرى

مواضيع عامة في علم الفلك

النجوم

البلازما

الألكترونيات

خواص المادة


الطاقة البديلة

الطاقة الشمسية

مواضيع عامة في الطاقة البديلة

المد والجزر

فيزياء الجسيمات


الفيزياء والعلوم الأخرى

الفيزياء الكيميائية

الفيزياء الرياضية

الفيزياء الحيوية

الفيزياء العامة


مواضيع عامة في الفيزياء

تجارب فيزيائية

مصطلحات وتعاريف فيزيائية

وحدات القياس الفيزيائية

طرائف الفيزياء

مواضيع اخرى
طيف الأشعة الصادرة من المصعد: الطيف المميز
المؤلف:
أ.د. نعيمة عبد القادر أحمد / أ.د. محمد أمين سلمان
المصدر:
علم البلورات والاشعة السينية
الجزء والصفحة:
ص95–98
2023-09-20
1980
يطلق هذا الوصف على الطيف الخطي لأنه يميز مادة المصعد وهو ناتج عن انتقال الإلكترونات بين مستويات الطاقة الذرية لمادة المصعد. ويكون لفوتونات الإشعاع المستمر ما يكفي من الطاقة لجعل الإلكترونات التي تشغل مدارات داخلية للذرات أن ترتفع من حيث الطاقة لتشغل مستويات أعلى. ويحدث بعد ذلك أن ترتد تلك الإلكترونات إلى الحالة المستقرة، ويصاحب ذلك انبعاث ناتج من الانتقالات بين مستويات الطاقة المختلفة.
ويحدث أن يتلقى إلكترون في القشرة K قدرا من الطاقة يجعله يتحرر من الذرة، ويأتي هذا القدر من الطاقة من الإشعاع المستمر. وعندما تفقد الذرة إلكترونا من القشرة، أي أنها تصبح مؤينة فليس من الضروري أن تقوم بإصدار فوتون والطاقة المنطلقة عند انتقال إلكترون خارجي إلى القشرة K، يمكن أن تستخدم في إخراج إلكترون آخر، وتسمى هذه العملية انبعاث «أوجيه».
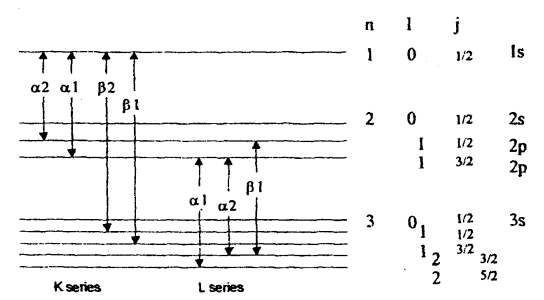
شكل (3-3)
مخطط مستويات الطاقة والأرقام الكمية المصاحبة لها.
وهناك تفسير بسيط للطيف الخطي للأشعة السينية في إطار قوانين الفيزياء الذرية، كما يبين الشكل (3-3) مخططا لمستويات الطاقة والأرقام الكمية المصاحبة لها والتي يمكن تلخيصها كما يلي:
1- قيم العدد الكمي الأساسي (n) هي التي تحدد القشرات M, L, K إلخ.
2- قيم العدد الكمي المداري الزاوي l هي التي تحدد المستويات d, p, s إلخ. وتتراوح قيم l (بالعلاقة 1 - n≥ l ≥ 0) من الصفر حتى (1-n).
3- يتخذ العدد الكمي المغناطيسي m القيم l ≥ m ≥ l –
4- يتخذ العدد الكمي المغزلي s القيم 1/2 ±
5- يتخذ العدد الكمي الزاوي الكلي j القيم j = l + s.
فإذا تأينت القشرة K (انتزع منها إلكترون) فإن الذرة تصبح في حالة ذات طاقة مقدارها EK، أما الموقع الشاغر لخروج الإلكترون فيتم ملؤه بواسطة إلكترون قادم من إحدى القشرات الخارجية للذرة. وتكتسب السلسلة اسمها من مستوى القشرة التي يتوجه إليها الإلكترون فالانتقال L→K يكتب αK والانتقال M→K يكتب βK وهكذا.
جدير بالذكر أن نفس مستوى الطاقة قد يحتوي على طاقات مدارية متقاربة جدا وهذا ما يؤدي إلى ظهور خطوط متعددة multiplets يميزها فرق طفيف في الطول الموجي، فمثلا:
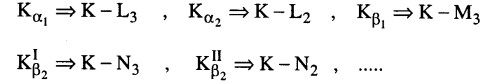
وتحدد قواعد الانتقاء في الفيزياء الذرية الانتقالات المسموح بها بين المستويات (أي التي تزيد احتمال حدوثها عن الصفر) وتتلخص تلك القواعد في ما يلي:
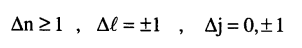
وتتحدد نهاية سلسلة طيفية ما بالحالة التي يقفز إليها إلكترون حر إلى المستوى المؤين ويكون الطول الموجي عندئذ هو:
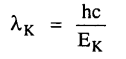
ولكي تنبعث سلسلة طيفية ما S فلابد أن تكون طاقة الإلكترونات الساقطة على الهدف أكبر من حد معين أو أن يكون فرق جهد تعجيل الإلكترونات أكبر من حد التأين الخاص بالمستوى S.
وتتناسب شدة خط طيفي ما مع احتمال الانتقال الإلكتروني من المستوى الابتدائي إلى المستوى النهائي والخطان α1,Kα2 K لهـما تقريبا نفس الطاقة الابتدائية، ولكن مستوى إشغال المستوى p5/22 (أربعة إلكترونات) هو مستوى الإشغال في المستوى 2p3/2 ولذلك فإن شدة الخط α1K ضعف شدة الخط α2K تقريبا إذا كان العدد الذرى Z يقع ما بين 20، 50.
جدول (3-1)
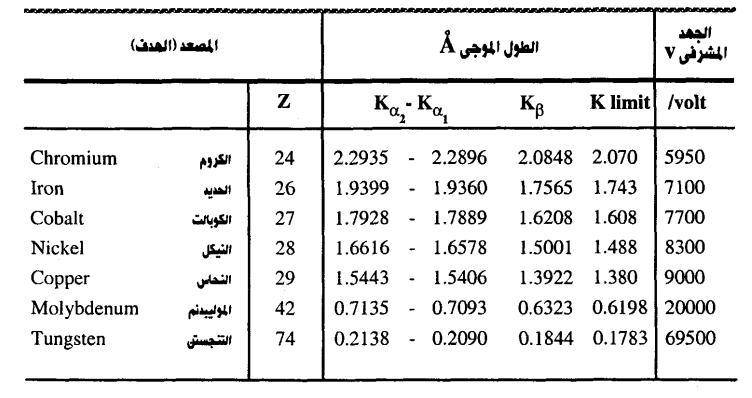
يبين الجدول (1-3) الأطوال الموجية المنبعثة من أكثر الأهداف شيوعا في مجال علم البلورات بالأشعة السينية (يعتبر الطول الموجي للإشعاع Cu Kα1λ من مصعد نحاسي عياريا ومقداره Å 1.5405974).
ومن المعروف أن خطوط انبعاث الأشعة السينية لا تتأثر تقريبا بالروابط الكيميائية بين العناصر؛ وذلك لأن استثارة الإلكترونات تتم في القشرات الداخلية للذرات ولا يعتمد تردد تلك الخطوط إلا على العدد الذرى Z للذرة طبقا لقانون «موزلي» التجريبي:
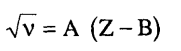
حيث المقداران A وB ثابتان يميزان السلسلة الطيفية.
يتم اختيار الأطوال الموجية عادة طبقا لثوابت الخلية البلورية للمركب المراد دراسته وكذلك حسب العناصر الكيميائية الموجودة في المركب. فلا يوصى – مثلا – باستخدام مصعد من النحاس عند دراسة مركب يحتوي على الحديد؛ لأن طاقة فوتونات αCu K من الكبر بحيث يمكنها تأيين المستوى K للحديد فيقوم الأخير بإصدار إشعاعه المميز مما يزيد من شدة إشعاع الطيف الأبيض (المستمر).
 الاكثر قراءة في الفيزياء الذرية
الاكثر قراءة في الفيزياء الذرية
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة

الآخبار الصحية















 قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة
قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة "المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة
"المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة (نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)
(نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)


















