


 علم الكيمياء
علم الكيمياء 
 الكيمياء التحليلية
الكيمياء التحليلية 
 الكيمياء الحياتية
الكيمياء الحياتية 
 الكيمياء العضوية
الكيمياء العضوية 
 الكيمياء الفيزيائية
الكيمياء الفيزيائية
 الكيمياء اللاعضوية
الكيمياء اللاعضوية 
 مواضيع اخرى في الكيمياء
مواضيع اخرى في الكيمياء
 الكيمياء الصناعية
الكيمياء الصناعية |
Read More
Date: 28-2-2017
Date: 2-2-2018
Date: 23-3-2017
|
Ground state electronic configurations:
experimental data
Now consider the ground state electronic configurations of isolated atoms of all the elements (Table 1). These are experimental data, and are nearly always obtained by analysing atomic spectra. Most atomic spectra are too complex for discussion here and we take their interpretation on trust.
We have already seen that the ground state electronic configurations of H and He are 1s1 and 1s2 respectively. The 1s atomic orbital is fully occupied in He and its configuration is often written as [He]. In the next two elements, Li and Be, the electrons go into the 2s orbital, and then from B to Ne, the 2p orbitals are occupied to give the electronic configurations [He]2s2 2pm (m = 1= 6). When m = 6, the energy level (or shell) with n = 2 is fully occupied, and the configuration for Ne can be written as [Ne]. The filling of the 3s and 3p atomic orbitals takes place in an analogous sequence from Na to Ar, the last element in the series having the electronic configuration [Ne]3s2 2p6 or [Ar]. With K and Ca, successive electrons go into the 4s orbital, and Ca has the electronic configuration [Ar]4s2. At this point, the pattern changes. To a first approximation, the 10 electrons for the next 10 elements (Sc to Zn) enter the 3d orbitals, giving Zn the electronic configuration 4s2 3d10.
There are some irregularities (see Table 1) to which we return later. From Ga to Kr, the 4p orbitals are filled, and the electronic configuration for Kr is [Ar]4s2 3d10 4p6 or [Kr]. From Rb to Xe, the general sequence of filling orbitals is the same as that from K to Kr although there are once again irregularities in the distribution of electrons between s and d atomic orbitals.
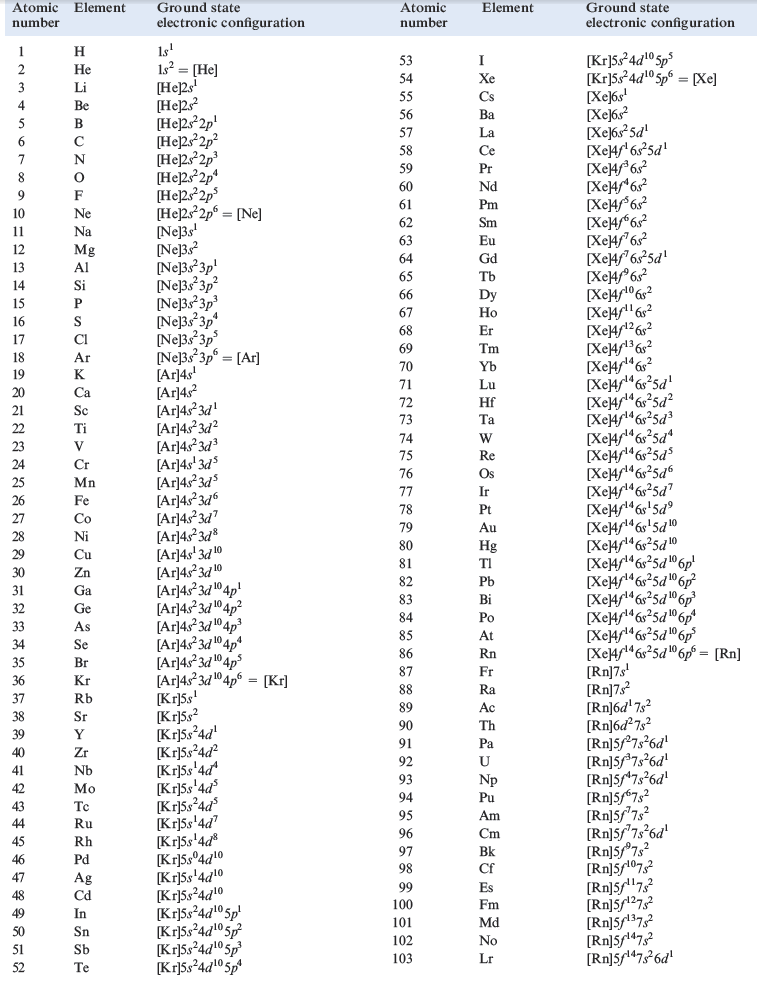
Cerium has the configuration [Xe]4f1 6s2 5d1 and the filling of the seven 4f orbitals follows until an electronic configuration of [Xe]4f14 6s2 5d1 is reached for Lu. Table 1.3 shows that the 5d orbital is not usually occupied for a lanthanoid element. After Lu, successive electrons occupy the remaining 5d orbitals (Hf to Hg) and then the 6p orbitals to Rn which has the configuration [Xe]4f 14 6s2 5d10 6p6 or [Rn]. Table 1.3 shows some irregularities along the series of d-block elements. For the remaining elements in Table 1.3 beginning at francium (Fr), filling of the orbitals follows a similar sequence as that from Cs but the sequence is incomplete and some of the heaviest elements are too unstable for detailed investigations to be possible. A detailed inspection of Table 1.3 makes it obvious that there is no one sequence that represents accurately the occupation of different sets of orbitals with increasing atomic number. The following sequence is approximately true for the relative energies (lowest energy first) of orbitals in neutral atoms:
1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 5d _ 4f < 6p < 7s < 6d ≈ 5f .



|
|
|
|
لخفض ضغط الدم.. دراسة تحدد "تمارين مهمة"
|
|
|
|
|
|
|
طال انتظارها.. ميزة جديدة من "واتساب" تعزز الخصوصية
|
|
|
|
|
|
|
مشاتل الكفيل تزيّن مجمّع أبي الفضل العبّاس (عليه السلام) بالورد استعدادًا لحفل التخرج المركزي
|
|
|