


 علم الكيمياء
علم الكيمياء 
 الكيمياء التحليلية
الكيمياء التحليلية 
 الكيمياء الحياتية
الكيمياء الحياتية 
 الكيمياء العضوية
الكيمياء العضوية 
 الكيمياء الفيزيائية
الكيمياء الفيزيائية
 الكيمياء اللاعضوية
الكيمياء اللاعضوية 
 مواضيع اخرى في الكيمياء
مواضيع اخرى في الكيمياء
 الكيمياء الصناعية
الكيمياء الصناعية | وزن معادلات الأكسدة والاختزال Balancing of Oxidation Reduction Equation: |
|
|
|
أقرأ أيضاً
التاريخ: 24-4-2017
التاريخ: 2024-02-07
التاريخ: 2024-02-08
التاريخ: 2023-09-23
|
إن وزن المعادلة تعتمد على معرفة عدد الإلكترونات المتبادلة فلنأخذ مثلاً التفاعل بين أيونات البرمنجنات وبيروكسيد الهيدروجين في محيط حامضي فالمعادلات الآتية :

تعد شكلياً صحيحة جميعها ، فعند الذرات والتبدلات متساوية على الجانبين في كل هذه المعادلات . وفي الحقيقة، فإن واحدة من هذه المعادلات ( الثالثة ) هي صحيحة حقاً وتعبر كمياً عن هذه العملية بصورة كافية ، فإذا ما اخترنا خطوات التأكسد والاختزال بصورة منفصلة ، فإن المعادلة الثالثة فقط تعطي عدداً متساوياً من الالكترونـــات فـــي الخطوتين .
ولكي يتم وزن المعادلات التأكسدية - الاختزالية يجب أن نكتشف عدد الالكترونات التي يفقدها العامل المختزل والتي يأخذها أو يكتسبها العامل المؤكسد وهذا يسهل عمله إذا ما عرفت معادلات تفاعل نصف الخلية للمنظومة التأكسدية والاختزالية المعينة . ففي المثال المذكور آنفاً إذا ما كتبنا معادلتي نصف الخلية .
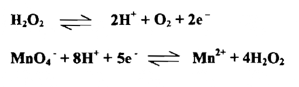
فإننا نستطيع أن نري حالاً 5 جزيئات فوق أكسيد الهيدروجين ستعطي 10 الكترونات والتي يأخذها أيونان من البرمنجنات ومن هذه النسبة يمكن موازنة المعادلة موازنة سهلة تامة وعامة أن وزن المعادلات التأكسدية - الاختزالية ينبغي أن تجري على وفق الخطوات الآتية :
1- تعيين نواتج التفاعل
2- وضع تفاعلي التأكسد والاختزال بمعادلات تفاعل نصف الخلية.
3- اضرب كل معادلة نصف خلية بمعامل بحيث يكون كل من المعادلتين يحتوي على نفس العدد من الالكترونات .
4- أخيراً اجمع هذه المعادلات واحذف المواد التي تظهر على جانبي المعادلة الناتجة . ومن الممكن توضيح العمليات المذكورة بالأمثلة الآتية :-
مثال توضيحي :-
صف التفاعل الذي يجري بين Sn+2, Fe+3
أ- يجب أن نعرف بأن النواتج هي Sn+2 Fe+3
ب- تفاعلات نصف الخلية هي كما يأتي :
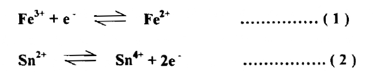
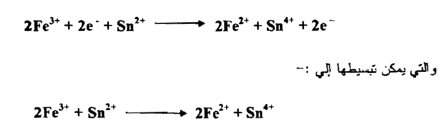
جـ - إذا ضربنا المعادلة ( 1 ) بالعدد 2 وجمعنا المعادلتين نحصل على المعادلة الآتية :


|
|
|
|
دخلت غرفة فنسيت ماذا تريد من داخلها.. خبير يفسر الحالة
|
|
|
|
|
|
|
ثورة طبية.. ابتكار أصغر جهاز لتنظيم ضربات القلب في العالم
|
|
|
|
|
|
|
تضمنت إقامة صلاة العيد واستقبال المهنئين.. مركز دولي تابع للعتبة الحسينية يقيم دورات دينية وجولات تبليغية في إندونيسيا
|
|
|