


 علم الكيمياء
علم الكيمياء 
 الكيمياء التحليلية
الكيمياء التحليلية 
 الكيمياء الحياتية
الكيمياء الحياتية 
 الكيمياء العضوية
الكيمياء العضوية 
 الكيمياء الفيزيائية
الكيمياء الفيزيائية
 الكيمياء اللاعضوية
الكيمياء اللاعضوية 
 مواضيع اخرى في الكيمياء
مواضيع اخرى في الكيمياء
 الكيمياء الصناعية
الكيمياء الصناعية |
أقرأ أيضاً
التاريخ: 3-1-2022
التاريخ: 10-10-2019
التاريخ: 2024-07-12
التاريخ: 2024-07-07
|
يعد ترتب هوفمان أحد الأمثلة الأساسية على هجرة مجموعة الألكيل أو الأريل من ذرة الكاربون إلى النيتروجين في الترتب الأنيونوتروبي. ففي هذا التفاعل تعامل الأميدات غير المعوضة مع هايبوبروميت الصوديوم ( NaOBr ) أو هيدروكسيد الصوديوم والبروم لتكوين الأمينات الأحادية الحاوية على ذرة كاربون واحدة أقل من الأميداث المستعملة كما في المعادلة التالية :
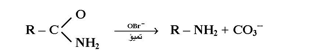
إن الناتج الفعلي للتفاعل هو الإيزوسيانات الذي نادراً ما يفصل من التفاعل وذلك بسبب تحلله في ظروف التفاعل لتكوين الأمين . كما ويمكن أن تكون مجموعة ( R ) في الأميد المستعمل مجموعة أريل أيضاً ( Ar) ويعتقد بأن التفاعل يحدث من خلال الميكانيكية التالية :
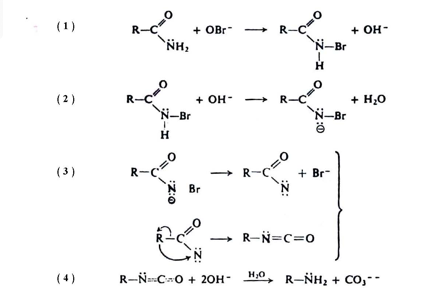
وتتضمن ميكانيكية هذا التفاعل في خطواته الأولى تكوين( N – هالو اميد ) من خلال تفاعل الأمين مع هايبو هاليد الصوديوم . أن المركب الناتج (N- هالواميد) يحتوي على هيدروجين حامضية بسبب وجود مجموعتين ساحبتين للإلكترونات متصلتين بذرة النيتروجين .
ووجد أن المجموعتين هما مجموعتا الكاربونيل والهالوجين لذلك يفقد هيدروجينة الحامضية بواسطة أيون الهيدروكسيد لتكوين أيون – Nهالواميد )الخطوة الثانية ) . أما الخطوة الثالثة التي يحدث فيها الترتب فتتضمن انتقال مجموعة الألكيل إلى النتروجين مما يساعد على دفع أيون الهاليد في نفس الوقت مع تكوين الأيسوسيانات .
أن هذا الترتب يشابه تفاعل Sn2 من حيث التوزيع الفراغي ( أي الاحتفاظ بالتوزيع الفراغي لمجموعة الألكيل ) . دلت الدراسات على أن ترتب هوفمان للأميدات النشيطة ضوئياً . والتي تتصل فيها ذرة الكاربون الكيرالية مباشرة مع مجموعة الكاربونيل . يحدث مع الاحتفاظ بالترتيب .
وهكذا فأن مجموعة R تهاجر إلى النيتروجين حاملة معها إلكتروناتها ولكن دون حدوث أنقلاب في الترتيب . أما الخطوة الرابعة فتتضمن تميؤ الأيزوسيانات لتكوين الأمينات وأيون الكاربونات .
وهناك نواتج أخرى جانبية يمكن أن تتكون خلال التفاعل إضافة إلى الأمين مثل اليوريا المعوضة بمجموعة الألكيل أو الأسيل نتيجة إضافة الأمين أو الأميد للأيزوسيانات على التوالي .
ولو قارنا ترتب هوفمان مع ترتيبات الكاتيون الكاربوني لوجدنا أنه في ترتيبات الكاتيون الكاربوني تهاجر المجموعة بزوجها الإلكتروني إلى ذرة الكاربون الفقيرة بالإلكترونات بينما في ترتب هوفمان تهاجر المجموعة بزوجها الإلكتروني إلى ذرة النيتروجين الفقيرة بالإلكترونات وذلك لوجود مجموعة الهالوجين والكاربونيل الساحبتين للإلكترونات .
ولقد توسعت الدراسات الخاصة بترتب هوفمان لتقف على حقيقة وطبيعة المركبات الوسطية المقترحة في الميكانيكية المشار إليها سابقاً . ولقد تم أثبات هذه الميكانيكية من خلال فصل بعض هذه المركبات الوسطية مثل الأيزوسيانات .



|
|
|
|
التوتر والسرطان.. علماء يحذرون من "صلة خطيرة"
|
|
|
|
|
|
|
مرآة السيارة: مدى دقة عكسها للصورة الصحيحة
|
|
|
|
|
|
|
نحو شراكة وطنية متكاملة.. الأمين العام للعتبة الحسينية يبحث مع وكيل وزارة الخارجية آفاق التعاون المؤسسي
|
|
|