


 علم الكيمياء
علم الكيمياء 
 الكيمياء التحليلية
الكيمياء التحليلية 
 الكيمياء الحياتية
الكيمياء الحياتية 
 الكيمياء العضوية
الكيمياء العضوية 
 الكيمياء الفيزيائية
الكيمياء الفيزيائية
 الكيمياء اللاعضوية
الكيمياء اللاعضوية 
 مواضيع اخرى في الكيمياء
مواضيع اخرى في الكيمياء
 الكيمياء الصناعية
الكيمياء الصناعية |
Read More
Date: 19-7-2017
Date: 28-9-2018
Date: 23-9-2018
|
Chemical Kinetics: Changing Reaction Speeds
Kinetics is the study of the speed of a reaction. Some reactions are fast; others are slow. Sometimes chemists want to speed the slow ones up and slow the fast ones down. For instance, if you’re a chemist who wants to make ammonia from a given amount of hydrogen and nitrogen, you want to produce ammonia as fast as possible. Several factors affect the speed of a reaction:
✓ Complexity of the reactants: In general, the reaction rate is slower when the reactants are large and complex molecules.
For a reaction to occur, the reactants have to collide at the reactive site of the molecule. The larger and more complex the reactant molecules are, the less chance of a collision at the reactive site. Sometimes, in very complex molecules, other parts of the molecule totally block off the reactive site, so no reaction occurs. There may be a lot of collisions, but only the ones that occur at the reactive site have any chance of leading to chemical reaction.
✓ Particle size of the reactants: Reaction depends on collisions. The more surface area on which collisions can occur, the faster the reaction. For instance, you can hold a burning match to a large chunk of coal and nothing will happen. But if you take that same piece of coal, grind it up very, very fine, throw it up into the air, and strike a match, you’ll get an explosion because of the increased surface area of the coal.
✓ Concentration of the reactants: Increasing the number of collisions speeds up the reaction rate. The more reactant molecules that are colliding, the faster the reaction will be. For example, a wood splint burns okay in air (20 percent oxygen), but it burns much faster in pure oxygen. In most simple cases, increasing the concentration of the reactants increases the speed of the reaction. However, if the reaction is complex and it has a complex mechanism (series of steps in the reaction), this may not be the case.
Determining the concentration effect on the rate of reaction can give you clues as to which reactant is involved in the step of the mechanism that determines the reaction speed. (You can then use this information to help figure out the reaction mechanism.) You can do this by running the reaction at several different concentrations and observing the effect on the rate of reaction. If, for example, changing the concentration of one reactant has no effect on the rate of reaction, then you know that reactant is not involved in the slowest step (the ratedetermining step) in the mechanism.
✓ Pressure of gaseous reactants: The pressure of gaseous reactants has basically the same effect as concentration. The higher the reactant pressure, the faster the reaction rate. This is due to (you guessed it!) the increased number of collisions. But if there’s a complex mechanism involved, changing the pressure may not have the result you expect.
✓ Temperature: In most cases, increasing the temperature causes the reaction rate to increase. In organic chemistry, a general rule says that increasing the temperature 10°C will cause the reaction rate to double.
But why is this true? Part of the answer is an increased number of collisions, because increasing the temperature causes the molecules to move faster. But this is only part of the story. Increasing the temperature also increases the average kinetic energy of the molecules. Increasing the temperature not only increases the number of collisions but also increases the number of collisions that are effective — that transfer enough energy to cause a reaction to take place.
✓ Catalysts: Catalysts are substances that increase the reaction rate without themselves being changed at the end of the reaction. They increase the reaction rate by lowering the reaction’s activation energy (the energy required to start the reaction). Look back at Figure below, for example.
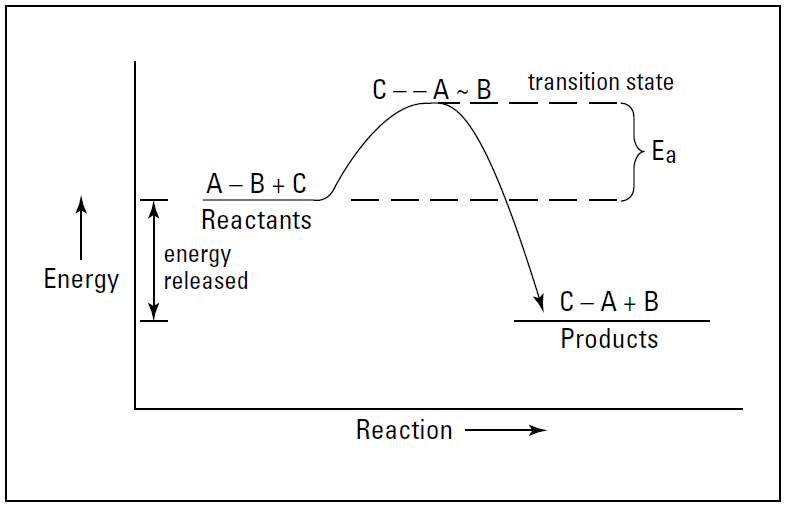


|
|
|
|
التوتر والسرطان.. علماء يحذرون من "صلة خطيرة"
|
|
|
|
|
|
|
مرآة السيارة: مدى دقة عكسها للصورة الصحيحة
|
|
|
|
|
|
|
دراسة تستعرض آلام السجناء السياسيين في حقبة البعث المجرم في العراق
|
|
|