


 علم الكيمياء
علم الكيمياء 
 الكيمياء التحليلية
الكيمياء التحليلية 
 الكيمياء الحياتية
الكيمياء الحياتية 
 الكيمياء العضوية
الكيمياء العضوية 
 الكيمياء الفيزيائية
الكيمياء الفيزيائية
 الكيمياء اللاعضوية
الكيمياء اللاعضوية 
 مواضيع اخرى في الكيمياء
مواضيع اخرى في الكيمياء
 الكيمياء الصناعية
الكيمياء الصناعية |
أقرأ أيضاً
التاريخ: 19-10-2020
التاريخ: 5-8-2018
التاريخ: 2024-02-28
التاريخ: 9-10-2020
|
سبق وأن أشرنا في الفصل الأول إلى أن الألكانات مركبات غير قطبية أن وبذلك نتوقع تكون غير نشطة كيميائياً أي أنها تدخل في عدد محدود من التفاعلات الكيميائية أهمها :
1 - هلجنة الألكانات ( تفاعل الألكانات مع الهالوجين Halogenation ) :
يتفاعل البروم والكلور في وجود الضوء أو الحرارة مع . الألكانات ليعطي بروميد أو كلوريد الألكيل على التوالي أما الفلور فهو نشيط جدا لدرجة أنه يخرب الألكان. واليود عنصر حامل حيث أنه لا يتفاعل مع الألكان حتى عند درجات الحرارة العالية. هذا، وأن كلورة الألكانات أكثر أهمية من برومتها وتحصل الكلورة عادة تحت ظروف أسهل من البرومة. إلا أن كلورة الألكانات تعطي خليطاً من کلوريدات الألكيل. فمثلا كلورة الميثان تعطي خليط من المركبات كما هو موضح بالمعادلات الآتية وذلك لأن التفاعل لا يتوقف عند تكوين كلوريد الميثل وإنما يحل محل هيدروجين كلوريد الميثل ليعطي ثنائي كلوريد الميثين وهكذا

يمكن فصل هذه النواتج بواسطة التقطير المجزأ وذلك لاختلاف درجة غليان تلك النواتج. كما يمكن الحصول على الناتج الأول فقط (كلوريد الميثل) بمعاملة كمية كبيرة من الميثان مع كمية قليلة جدا من الكلور وبذلك لا يجد الكلور فرصة لإعطاء النواتج الأخرى.
تتم عملية برومة وكلورة الألكانات عن طريقة الاستبدال بالجذور (الشقوق) الحرة Free radicals substitution ويمكن تعريف الجذر الحر بأنه أي ذرة أو مجموعة تحمل الكتروناً منفرداً غير متزاوج. تتم ميكانية التفاعل بثلاث خطوات. وتجدر الإشارة إلى أن ميكانية التفاعل تعني الكيفية التي يتم بها التفاعل والمراحل الوسطية التي يمر عليها التفاعل حتى يصل إلى الناتج النهائي.
هذه الثلاث خطوات موضحة كالتالي :-
1- مرحلة بداية التفاعل أو .Initiation step التنشيط , تتم هذه الخطوة بشطر جزىء الكلور إلى ذرتين حرتين بواسطة الضوء او الحرارة
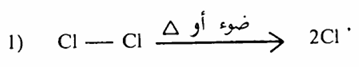
2- مرحلة نمو التفاعل
يتم في هذه الخطوة شطر الرابطة بين الكربون والهيدروجين بواسطة ذرة الكلور الحرة النشيطة لتكوين جذر ألكيلي حر وكلوريد
الهيدروجين يلي ذلك تفاعل الجذر الألكيلي الحر النشيط مع الكلور ليعطي كلوريد الألكيل وذرة كلور حرة.

وتتكرر الخطوتان السابقتان حتى يكتمل التفاعل (حيث يتفاعل الكلور الحر الناتج من خطوة 2b مع الميثان ليعطي التفاعل ثم يتفاعل الألكيل الحر الناتج من خطوة  2a مع الكلور ليعطي التفاعل 2b وهكذا)
2a مع الكلور ليعطي التفاعل 2b وهكذا)
3- مرحلة نهاية التفاعل Termination step , يكتمل هذا التفاعل عندما يتحد جدران متماثلان أو مختلفان)
كما يلي :

تختلف الألكانات العليا في مدى نشاطها تجاه الهالوجينات. فالألكانات النظامية أقل نشاطاً الثانوية وهذه أقل من الثالثية، حيث أن من الطاقة اللازمة لشطر ذرة هيدروجين من ألكان نظامي أكبر من الثانوي وهذه أكبر من الثالثي. وبذلك يكون جذر الألكيل النظامي أعلى طاقة (أقل استقرار من الثانوي وهذا بدوره أعلى طاقة من الثالثي)

على سبيل المثال، كلورة البيوتان النظامي تعطي 28% كلوريد بيوتيل نظامي، 72 كلوريد بيوتيل ثانوي كما أن برومة البيوتان تعطي 2 و 98% من بروميد بيوتيل نظامي وبروميد بيوتيل ثانوي على التوالي، أما برومة الايزوبيوتان فتعطي أكثر من99% من بروميد بيوتيل ثالثي .





|
|
|
|
التوتر والسرطان.. علماء يحذرون من "صلة خطيرة"
|
|
|
|
|
|
|
مرآة السيارة: مدى دقة عكسها للصورة الصحيحة
|
|
|
|
|
|
|
نحو شراكة وطنية متكاملة.. الأمين العام للعتبة الحسينية يبحث مع وكيل وزارة الخارجية آفاق التعاون المؤسسي
|
|
|