
تاريخ الفيزياء

علماء الفيزياء


الفيزياء الكلاسيكية

الميكانيك

الديناميكا الحرارية


الكهربائية والمغناطيسية

الكهربائية

المغناطيسية

الكهرومغناطيسية


علم البصريات

تاريخ علم البصريات

الضوء

مواضيع عامة في علم البصريات

الصوت


الفيزياء الحديثة


النظرية النسبية

النظرية النسبية الخاصة

النظرية النسبية العامة

مواضيع عامة في النظرية النسبية

ميكانيكا الكم

الفيزياء الذرية

الفيزياء الجزيئية


الفيزياء النووية

مواضيع عامة في الفيزياء النووية

النشاط الاشعاعي


فيزياء الحالة الصلبة

الموصلات

أشباه الموصلات

العوازل

مواضيع عامة في الفيزياء الصلبة

فيزياء الجوامد


الليزر

أنواع الليزر

بعض تطبيقات الليزر

مواضيع عامة في الليزر


علم الفلك

تاريخ وعلماء علم الفلك

الثقوب السوداء


المجموعة الشمسية

الشمس

كوكب عطارد

كوكب الزهرة

كوكب الأرض

كوكب المريخ

كوكب المشتري

كوكب زحل

كوكب أورانوس

كوكب نبتون

كوكب بلوتو

القمر

كواكب ومواضيع اخرى

مواضيع عامة في علم الفلك

النجوم

البلازما

الألكترونيات

خواص المادة


الطاقة البديلة

الطاقة الشمسية

مواضيع عامة في الطاقة البديلة

المد والجزر

فيزياء الجسيمات


الفيزياء والعلوم الأخرى

الفيزياء الكيميائية

الفيزياء الرياضية

الفيزياء الحيوية

الفيزياء والفلسفة

الفيزياء العامة


مواضيع عامة في الفيزياء

تجارب فيزيائية

مصطلحات وتعاريف فيزيائية

وحدات القياس الفيزيائية

طرائف الفيزياء

مواضيع اخرى
توزيع السرعات الجزيئية
المؤلف:
فريدريك بوش ، دافيد جيرد
المصدر:
اساسيات الفيزياء
الجزء والصفحة:
ص 388
3-7-2016
7538
توزيع السرعات الجزيئية
افترضنا ضمنياً ان جزيئات الغاز لا تتحرك جميعها بنفس السرعة ، ولكننا لم نحدد توزيع هذه السرعات، بمعنى أننا لم نذكر النسبة العددية للجزيئات التي تتحرك بسرعة معينة أو في مدى معينة للسرعة. وقد استخدم الفيزيائي الاسكتلندي جيمس كليرك ماكسويل نظرية الحركة للغازات في عام 1860 لاشتقاق تعبير نظري لوصف العدد النسبي من جزيئات الغاز الذي يتحرك بسرعة معينة عند درجة حرارة معينة T. هذه العلاقة تسمى توزيع ماكسويل، وهي موضحة بيانياً بالشكل 1)) لجزيئات غاز O2 عند درجة 273 K. لاحظ أن هناك سرعتين أخريين، بالإضافة إلى vrms، مبينتين على المنحني ، وهاتان السرعتان مهمتان من الناحية الإحصائية. السرعة الأولى وهي vm تسمى السرعة الأكثر احتمالاً، وهي تمثل السرعة التي يتحرك بها اكبر عدد من الجزيئات. اما السرعة الثانية ṽ فهي السرعة المتوسطة للجزيئات . وتعطي هذه السرعات الثلاث بالمعادلات الآتية:

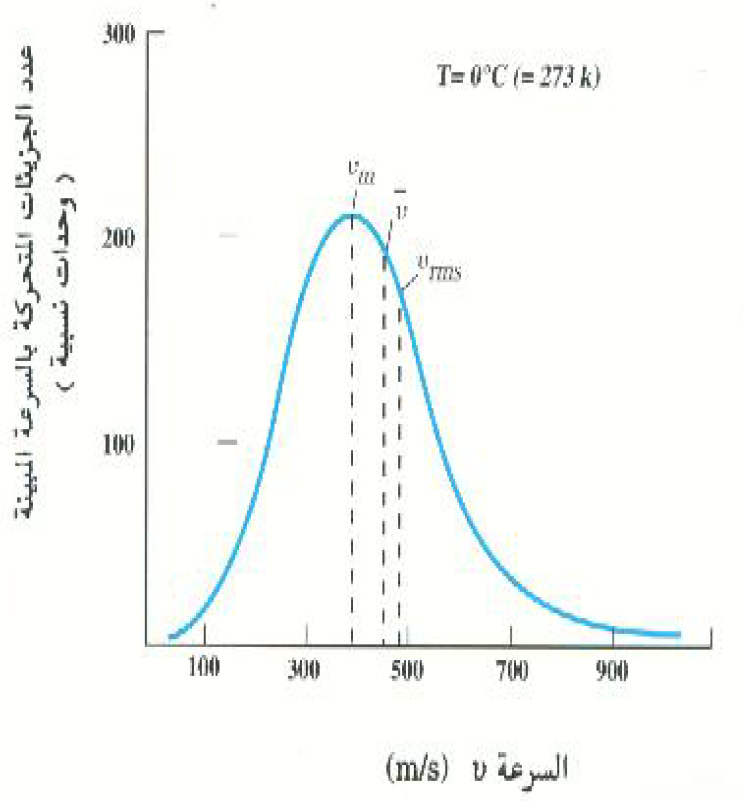
الشكل 1)): التوزيع الماكسويلي للسرعات في عينة من غاز O2 عند 273 K. قيم السرعة الأكثر احتمالاً vm والسرعة المتوسط ṽ وجذر متوسط مربع السرعة vrms موضحة على المنحني.
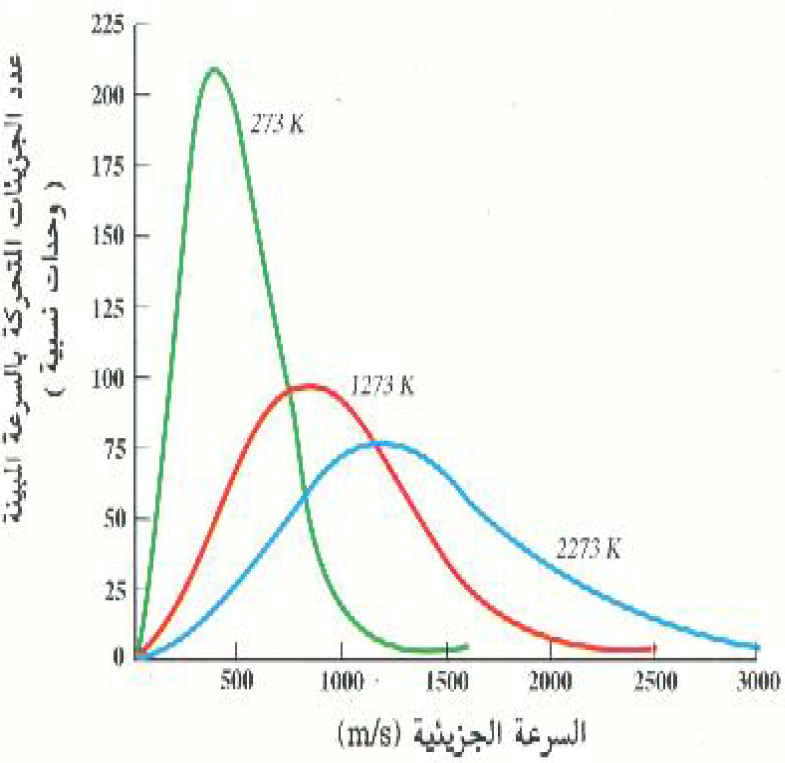
الشكل 2)( : توزيع السرعات الجزيئية لغاز N2. تتحرك قمة منحني التوزيع تجاه السرعات الأعلى ويزداد اتساع المنحني بزيادة درجة حرارة الغاز.
وعليه فإذا علمت قيمة إحدى هذه السرعات يمكن إيجاد السرعتين الأخريين بسهولة.
يوضح الشكل 2)) كيف يتغير توزيع السرعات في عينة من غاز N2 بتغير درجة الحرارة. ويبين هذا الشكل أن ارتفاع درجة الحرارة يؤدي إلى تفلطح منحني توزيع السرعات وإزاحة قمته vm في اتجاه القيم لأعلى. ويلاحظ أيضاً من شكل توزيع ماكسويل للسرعات أن هناك دائماً عدداً قليلاً من الجزيئات التي تتحرك ببطئ شديد ، كما أن هناك دائماً عدداً قليلاً منها يتحرك بسرعات أكبر كثيراً من vrms.
وتجدر الإشارة هناك إلى أن نظرية ماكسويل كانت موضع الكثير من الجدل حين إعلانها. ذلك أن الاختيار العملي لهذه النظرية كان يستلزم استعمال غرفة مفرغة منخفضة الضغط جداً حتى يمكن قياسات السرعات الجزيئية بدون التصادمات التي تغير اتجاهات السرعة باستمرار، وهذا لم يتوفر في ذلك الحين. ولكن بحلول 1926 استطاع الفيزيائي الألماني أوتوشتيرن إجراء تجربته الشهيرة التي أكدت تنبؤات ماكسويل النظرية عن توزيع السرعات الجزيئية. والواقع أن نظرية ماكسويل والتأكيد العملي لها يمثل خطوة هامة للغاية على الطريق في مجال فهم الخواص الحرارية للمادة.
 الاكثر قراءة في الفيزياء الكيميائية
الاكثر قراءة في الفيزياء الكيميائية
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة

الآخبار الصحية















 قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة
قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة "المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة
"المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة (نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)
(نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)


















