
تاريخ الفيزياء

علماء الفيزياء


الفيزياء الكلاسيكية

الميكانيك

الديناميكا الحرارية


الكهربائية والمغناطيسية

الكهربائية

المغناطيسية

الكهرومغناطيسية


علم البصريات

تاريخ علم البصريات

الضوء

مواضيع عامة في علم البصريات

الصوت


الفيزياء الحديثة


النظرية النسبية

النظرية النسبية الخاصة

النظرية النسبية العامة

مواضيع عامة في النظرية النسبية

ميكانيكا الكم

الفيزياء الذرية

الفيزياء الجزيئية


الفيزياء النووية

مواضيع عامة في الفيزياء النووية

النشاط الاشعاعي


فيزياء الحالة الصلبة

الموصلات

أشباه الموصلات

العوازل

مواضيع عامة في الفيزياء الصلبة

فيزياء الجوامد


الليزر

أنواع الليزر

بعض تطبيقات الليزر

مواضيع عامة في الليزر


علم الفلك

تاريخ وعلماء علم الفلك

الثقوب السوداء


المجموعة الشمسية

الشمس

كوكب عطارد

كوكب الزهرة

كوكب الأرض

كوكب المريخ

كوكب المشتري

كوكب زحل

كوكب أورانوس

كوكب نبتون

كوكب بلوتو

القمر

كواكب ومواضيع اخرى

مواضيع عامة في علم الفلك

النجوم

البلازما

الألكترونيات

خواص المادة


الطاقة البديلة

الطاقة الشمسية

مواضيع عامة في الطاقة البديلة

المد والجزر

فيزياء الجسيمات


الفيزياء والعلوم الأخرى

الفيزياء الكيميائية

الفيزياء الرياضية

الفيزياء الحيوية

الفيزياء والفلسفة

الفيزياء العامة


مواضيع عامة في الفيزياء

تجارب فيزيائية

مصطلحات وتعاريف فيزيائية

وحدات القياس الفيزيائية

طرائف الفيزياء

مواضيع اخرى
الغليان والتجمد
المؤلف:
بيتر أتكينز
المصدر:
الكيمياء الفيزيائية
الجزء والصفحة:
ص 75 – ص 78
2024-10-01
2075
ربما يطرح عالم الكيمياء الفيزيائية هذا السؤال: لماذا تتغير المادة من شكل إلى آخر عندما تتغير الظروف من حولها ؟ من جهة، لا بد أن الإجابة عن هذا السؤال تكمن في الديناميكا الحرارية التي تحدد اتجاه التغيير التلقائي.
تُعد طاقة جيبس مؤشرًا على اتجاه التغير التلقائي. ومع ذلك، عند مناقشة حالات الاتزان، يرى علماء الكيمياء الفيزيائية أنه من المناسب الاستعانة بالخاصية التي قدمها جوسايا جيبس في معادلته الأصلية للديناميكا الحرارية الكيميائية والمتمثلة في «الجهد الكيميائي»، ويرمز إليه بـ μ (مو). وبقدر ما يعنينا الأمر هنا، يمكن النظر إلى الجهد الكيميائي باعتباره طاقة جيبس التي تتمتع بها كتلة بحجم قياسي من العينة (بتعبير أدق، بالنسبة إلى المادة النقية، الجهد الكيميائي هو طاقة جيبس المولية، أي طاقة جيبس لكل مول من الذرات أو الجزيئات.) والتسمية معبرة للغاية، لأنه يمكن اعتبار الجهد الكيميائي قوة الدفعة الكيميائية الخاصة بمادة ما. وبالتالي، إذا كان الجهد الكيميائي الخاص بسائل ما أكبر من الجهد الكيميائي الخاص ببخار ما، إذن يميل السائل إلى تكوين البخار. وإذا كان العكس صحيحا، يكون الدفع في الاتجاه المعاكس ويكون للبخار ميل ليتكاثف ويتحول إلى السائل. وإذا تساوى الجهد الكيميائي وقوة الدفع الخاصة بكل من البخار والسائل، تكون حالتا المادة متوازنتين تكونان في حالة اتزان ولا يكون هناك ميل إجمالي نحو التبخر أو التكاثف. تخيل لعبة شد الحبل، بحيث يحل الدفع محل الشد أو الجذب.
ويمكن التعبير عن جميع أنواع التغيرات في الحالة وحالات الاتزان المناظرة التي يتوصل إليها عند التحول بين الحالات من خلال الجهد الكيميائي وقوة الدفع التي يمثلها. ويبتكر علماء الكيمياء الفيزيائية تعبيرات من أجل الجهد الكيميائي الخاص بمادة ما لتحديد الظروف التي تكون فيها أي حالتين (أو أكثر) من حالات المادة في حالة اتزان. فعلى سبيل المثال، ربما يُثبتون الضغط عند 1 ضغط جوي (وهو الضغط الجوي الطبيعي عند مستوى سطح البحر) ثم يُغيرون قيمة درجة الحرارة في المعادلات الخاصة بهم حتى يتطابق الجهد الكيميائي لحالتي السائل والبخار تكون درجة الحرارة هذه هي «نقطة غليان» المادة. وبدلا من ذلك، قد يغيرون درجة الحرارة في تعبيرات الجهد الكيميائي للشكلين السائل والصلب للمادة ويبحثون عن درجة الحرارة التي يتساوى عندها الجهدان الكيميائيان. وعند درجة الحرارة هذه، تصل المادة بحالتيها الصلبة والسائلة إلى حالة الاتزان وتسمى «نقطة تجمد» المادة.
بالطبع، سيضع عالم الكيمياء الفيزيائية المتمرس في اعتباره دومًا ما يحدث على المستوى الجزيئي ليتسبب في تغير الجهد الكيميائي. ويُعد الجهد الكيميائي، مثل طاقة جيبس نفسها، شكلًا مستترًا من أشكال الإنتروبي الكلي للنظام والوسط المحيط به. فإذا كان الجهد الكيميائي الخاص بالبخار أقل من ذلك الخاص بالسائل (مما يشير إلى ميل للتبخر)، فهذا يعني أن الإنتروبي الكلي بعد عملية التبخر أكبر مما كان عليه قبلها. وثمة عاملان مساهمان في تلك الزيادة. يتمثل أحدهما في زيادة إنتروبي النظام الذي يصحب انتشار السائل المضغوط على هيئة غاز. أما الآخر فيتمثل في انخفاض إنتروبي الوسط المحيط عند تدفق الحرارة منه إلى النظام لتمكين الجزيئات من التحرر من الجزيئات المجاورة. ذلك الانخفاض في الإنتروبي يعاكس زيادة إنتروبي النظام وقد يطغى عليه. في تلك الحالة، يكون الإنتروبي الكلي أقل بعد عملية التبخر ويكون الاتجاه التلقائي للتغير في الاتجاه العكسي، أي التكاثف ومع ذلك، ينبغي أن تتذكر من الفصل الثاني أن التغير في الإنتروبي يُحسب من خلال قسمة الحرارة المكتسبة أو المفقودة على درجة الحرارة التي حدث عندها الانتقال ويترتب على ذلك أنه إذا زادت درجة الحرارة، سيكون الانخفاض في إنتروبي الوسط المحيط أقل (تُقسم نفس حرارة الانتقال على عدد أكبر). وستأتي نقطة تكون فيها درجة الحرارة عالية جدًّا لدرجة أن صافي التغير يتحول من الانخفاض إلى الارتفاع (انظر شكل (5–1). وحينئذ يصير التبخر تلقائيا.
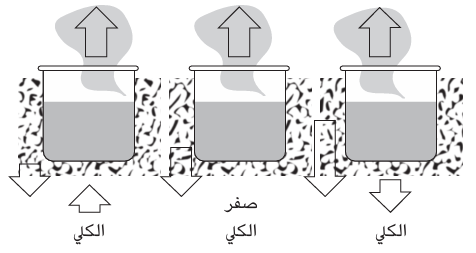
شكل 5–1: المراحل الثلاثة المتضمنة في الأحداث التي تؤدي إلى الغليان. عند درجات الحرارة المنخفضة، يكون انخفاض إنتروبي الوسط المحيط كبير جدًّا لدرجة أنه يطغى على زيادة إنتروبي النظام ويكون التكاثف تلقائيًّا. وعند درجات الحرارة المرتفعة، يحدث العكس ويكون التبخر تلقائيًّا. ويحدث الاتزان عندما تكون درجة الحرارة متوسطة ويتساوى تغيرا الإنتروبيين. تكون درجة الحرارة هذه هي نقطة الغليان. تشير الأسهم إلى تغيرات الإنتروبي.
لقد بينت الكيمياء الفيزيائية سبب تبخر المواد عند ارتفاع درجة الحرارة، والإجابة غريبة جدًّا فعلًا فالزيادة في درجة الحرارة تحد من انخفاض الإنتروبي في الوسط المحيط لدرجة أنها لم تعد تطغى على زيادة إنتروبي النظام في الواقع، يخفف ارتفاع درجة الحرارة من حدة التغيرات في الوسط المحيط بحيث يصبح التغير في إنتروبي النظام هو السائد. وتُعد نقطة الغليان – وكذلك نقطة التجمد بنفس المنطق – تجسيدين لقدرتنا على التلاعب بتغير الإنتروبي في الوسط المحيط من خلال تعديل درجة حرارته.
والآن، دعنا نتأمل الدور الذي يلعبه الضغط. كان أول النجاحات التي حققتها الديناميكا الحرارية الكيميائية هو التنبؤ الذي وصل إليه بينوا (إميل) كلابيرون (1799–1864) بخصوص تأثير الضغط على نقطة تجمد السوائل؛ وهو النجاح الذي أوحى إلى علماء العصر الفيكتوري بأنهم كانوا على الطريق الصحيح فيما يخص علم الطاقة الناشئ. الصورة البديهية واضحة تمامًا. تنكمش عينة معظم السوائل عندما تتجمد، إذن (وفقًا إلى مبدأ لو شاتلييه ومن الناحية العملية) تأتي زيادة الضغط لصالح المادة الصلبة ولا تكون هناك حاجة إلى خفض درجة الحرارة كثيرًا حتى يحدث التجمد. وهذا يعني أن تطبيق الضغط يرفع درجة التجمد . والماء ، كما هي الحال في معظم الأشياء، لافت للنظر؛ إذ إن الثلج أقل كثافة من الماء السائل، لهذا يتمدد الماء عندما يتجمد (فتطفو الجبال الجليدية، ومن المفارقات أن سفينة «تايتانيك» غرقت لهذا السبب). في هذه الحالة، يأتي تطبيق الضغط لصالح السائل، وبالتالي لا يتحقق التجمد إلا من خلال خفض درجة الحرارة أكثر. هذا يعني أن تطبيق الضغط يخفض نقطة التجمد بالنسبة إلى الماء. تسهم تلك الاستجابة في سريان الأنهار الجليدية إلى الأمام، حيث يذوب الجليد عندما يحتك بالحواف الحادة للصخور الدفينة.
قدمت حسابات كلابيرون تنبؤات حول تأثير الضغط على نقطة انصهار الماء من حيث الفرق في كثافة الثلج والماء السائل، ولم تكن تنبؤاته في الاتجاه الصحيح فحسب (أي إن الضغط يقلل نقطة التجمد) وإنما كانت قريبة أيضًا من القيمة العددية التي رصدت. يعرف علماء الكيمياء الفيزيائية الآن طريقة إعداد التعبير العام: يمكنهم حساب تأثير الضغط على الجهد الكيميائي لكل من الثلج والماء ومن ثم تحديد كيفية ضبط درجة الحرارة بحيث يظل الجهد الكيميائي متساويًا عندما يتغير الضغط. ويمكنهم إجراء حسابات مماثلة حول تأثير الضغط على نقاط الغليان (بحيث تؤدي زيادة الضغط دائمًا إلى زيادة نقطة الغليان).
 الاكثر قراءة في الفيزياء الكيميائية
الاكثر قراءة في الفيزياء الكيميائية
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة

الآخبار الصحية















 قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة
قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة "المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة
"المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة (نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)
(نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)


















