
تاريخ الفيزياء

علماء الفيزياء


الفيزياء الكلاسيكية

الميكانيك

الديناميكا الحرارية


الكهربائية والمغناطيسية

الكهربائية

المغناطيسية

الكهرومغناطيسية


علم البصريات

تاريخ علم البصريات

الضوء

مواضيع عامة في علم البصريات

الصوت


الفيزياء الحديثة


النظرية النسبية

النظرية النسبية الخاصة

النظرية النسبية العامة

مواضيع عامة في النظرية النسبية

ميكانيكا الكم

الفيزياء الذرية

الفيزياء الجزيئية


الفيزياء النووية

مواضيع عامة في الفيزياء النووية

النشاط الاشعاعي


فيزياء الحالة الصلبة

الموصلات

أشباه الموصلات

العوازل

مواضيع عامة في الفيزياء الصلبة

فيزياء الجوامد


الليزر

أنواع الليزر

بعض تطبيقات الليزر

مواضيع عامة في الليزر


علم الفلك

تاريخ وعلماء علم الفلك

الثقوب السوداء


المجموعة الشمسية

الشمس

كوكب عطارد

كوكب الزهرة

كوكب الأرض

كوكب المريخ

كوكب المشتري

كوكب زحل

كوكب أورانوس

كوكب نبتون

كوكب بلوتو

القمر

كواكب ومواضيع اخرى

مواضيع عامة في علم الفلك

النجوم

البلازما

الألكترونيات

خواص المادة


الطاقة البديلة

الطاقة الشمسية

مواضيع عامة في الطاقة البديلة

المد والجزر

فيزياء الجسيمات


الفيزياء والعلوم الأخرى

الفيزياء الكيميائية

الفيزياء الرياضية

الفيزياء الحيوية

الفيزياء العامة


مواضيع عامة في الفيزياء

تجارب فيزيائية

مصطلحات وتعاريف فيزيائية

وحدات القياس الفيزيائية

طرائف الفيزياء

مواضيع اخرى
الرابطة الأيونية
المؤلف:
بيتر أتكينز
المصدر:
الكيمياء الفيزيائية
الجزء والصفحة:
ص 18 – ص 20
2024-10-01
1111
«الرابطة الكيميائية» هي ما يربط الذَّرّات المتجاورة معًا لتكوين البنى المعقدة الخاصة بالعالم من حولنا. وتنشأ جميع الروابط الكيميائية من تغيرات في توزيع الإلكترونات في الذرات المتحدة، وبالتالي فإن تكوينها يقع بشكل كبير جدًّا ضمن اختصاص علم الكيمياء الفيزيائية.
يميز الكيميائيون بين ثلاثة أنواع من الروابط: الرابطة الأيونية والرابطة التساهمية والرابطة الفلزية. تتكون المواد المتحدة أيونيًا من كاتيونات وأنيونات مرتبطة معًا نتيجة للتجاذب بين شحناتها الكهربائية المعاكسة. وأشهر مثال على هذا النوع من الروابط هو كلوريد الصوديوم، ملح الطعام، الذي كل حبة منه تتكون من عدد كبير من كاتيونات الصوديوم (Na+) التي تتجمع معاً مع عدد مساو من أيونات الكلوريد (CI–). وربما يكون مصطلح «تجمع» مصطلحا مضللا، فالمركب ليس مجرد خليط عشوائي من الأيونات وإنما صفوف متراصة منها، كل أيون Na+ تحيط به ستة أيونات CI– وكل أيون CI– بدوره تحيط به ستة أيونات Na+ في مصفوفة شديدة الترتيب تمتد عبر البلورة الصغيرة (انظر شكل 1–3).
يحدد علماء الكيمياء الفيزيائية عدة سمات مهمة للرابطة الأيونية. إحداها أنها ليست برابطة تترابط فيها أيونات فردية بعضها مع بعض. وما أطلقت عليه «التجمع معًا» يحدث نتيجة أن جميع الأيونات في البلورة تتفاعل بعضها مع بعض فأيون Na+ يتفاعل على نحو مُواتٍ مع أيونات CI– المحيطة به، لكنه يتنافر مع أيونات Na+ المحيطة بكل من أيونات CI– هذه، ثم يتفاعل على نحو مواتٍ مع الصف التالي من أيونات CI–، وعلى نحو غير مواتٍ مع الصف التالي من أيونات Na+ وهلم جرا. وتتضاءل عمليات التجاذب والتنافر بفعل المسافة؛ غير أنه يجب النظر إلى الترابط الأيوني باعتباره سمة شاملة للبلورة، وليست سمة موضعية.
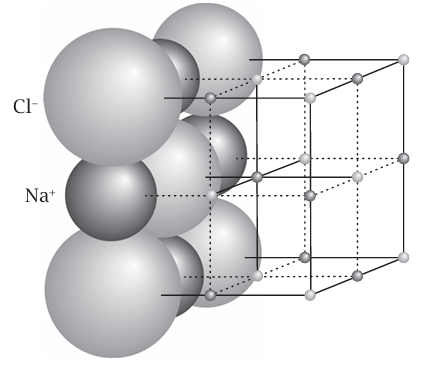
شكل 1–3: بنية كلوريد الصوديوم (NaCl). كل أيون صوديوم (Na+) محاط بستة أيونات كلوريد (CI–)، وكل أيون CI– مُحاط بستة أيونات .Na+. ويتكرر هذا النمط عبر البلورة.
وتعود قوة الرابطة الأيونية، والسبب وراء وجودها، إلى أن الأيونات الموجودة في البلورة تمتلك طاقة أقل من نفس العدد من ذرات الصوديوم والكلور الفردية المتباعدة على نطاق واسع. وهذا هو الموضع الذي تلعب فيه طاقة التأين والميل الإلكتروني دورًا مهما لتحديد ما إذا كان تكوين رابطة مواتيًا أم غير ذلك. وهنا يتحول علماء الكيمياء الفيزيائية إلى محاسبين يحسبون الأرباح والخسائر. ومن الوهلة الأولى، يوضح بيان الميزانية الخسارة بدلًا من الربح. فطاقة التأين الخاصة بالصوديوم قليلة، إلا أن إلكترونها الخارجي المنفرد لا ينفصل بسهولة؛ إذ يتطلب انتزاعه استثمار قدر هائل من الطاقة. والميل الإلكتروني الخاص بالكلور يعوض ذلك الاستثمار تعويضًا جزئيًا، بالطاقة المنبعثة حين يرتبط الإلكترون بذرة كلور لتكوين CI–. رغم ذلك، لا تزال هذه العملية بأكملها تتطلب طاقة لأن انخفاض الطاقة الذي يحدث في الخطوة الثانية أقل بكثير من الطاقة المطلوبة في خطوة التأين الأولى. وانبعاث الطاقة الإضافي الذي يحول الخسارة إلى ربح هو نتيجة التفاعل الإجمالي المواتي بشدة بين الأيونات التي تكونت وهي الطاقة التي تنبعث عند تجمعها معا. في الواقع، هذا التراجع المهول في الطاقة يؤدي إلى ظهور الأيونات وتنتج عنه بلورة مستقرة من كلوريد الصوديوم.
الآن، يمكنك ملاحظة سمة ثالثة للروابط الأيونية؛ ألا وهي أنها تتكون بالأساس بين ذرات العناصر الموجودة يسار الجدول الدوري وتلك الموجودة على يمينه. تتمتع ذرات العناصر الموجودة في اليسار بطاقة تأين منخفضة، وبالتالي تكون الطاقة المستثمرة لتكوين الكاتيونات منخفضة على نحو معقول وتتمتع ذرات العناصر الموجودة في اليمين بميل إلكتروني عال إلى حد معقول، ومن ثم يكون هناك انخفاض معقول في الطاقة عندما تكون أنيونات. وتتحول هذه الخسارة الصافية (وهي خسارة دومًا، لأن طاقة التأين عالية والميل الإلكتروني في هذه الحالة لا يسعف كثيرًا) إلى ربح من خلال التجاذب الإجمالي العام بين الأيونات.
 الاكثر قراءة في الفيزياء الكيميائية
الاكثر قراءة في الفيزياء الكيميائية
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة

الآخبار الصحية















 قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة
قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة "المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة
"المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة (نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)
(نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)


















