

علم الكيمياء

تاريخ الكيمياء والعلماء المشاهير

التحاضير والتجارب الكيميائية

المخاطر والوقاية في الكيمياء

اخرى

مقالات متنوعة في علم الكيمياء

كيمياء عامة


الكيمياء التحليلية

مواضيع عامة في الكيمياء التحليلية

التحليل النوعي والكمي

التحليل الآلي (الطيفي)

طرق الفصل والتنقية


الكيمياء الحياتية

مواضيع عامة في الكيمياء الحياتية

الكاربوهيدرات

الاحماض الامينية والبروتينات

الانزيمات

الدهون

الاحماض النووية

الفيتامينات والمرافقات الانزيمية

الهرمونات


الكيمياء العضوية

مواضيع عامة في الكيمياء العضوية

الهايدروكاربونات

المركبات الوسطية وميكانيكيات التفاعلات العضوية

التشخيص العضوي

تجارب وتفاعلات في الكيمياء العضوية


الكيمياء الفيزيائية

مواضيع عامة في الكيمياء الفيزيائية

الكيمياء الحرارية

حركية التفاعلات الكيميائية

الكيمياء الكهربائية


الكيمياء اللاعضوية

مواضيع عامة في الكيمياء اللاعضوية

الجدول الدوري وخواص العناصر

نظريات التآصر الكيميائي

كيمياء العناصر الانتقالية ومركباتها المعقدة


مواضيع اخرى في الكيمياء

كيمياء النانو

الكيمياء السريرية

الكيمياء الطبية والدوائية

كيمياء الاغذية والنواتج الطبيعية

الكيمياء الجنائية


الكيمياء الصناعية

البترو كيمياويات

الكيمياء الخضراء

كيمياء البيئة

كيمياء البوليمرات

مواضيع عامة في الكيمياء الصناعية

الكيمياء الاشعاعية والنووية
الهدرجة. حرارة الهدرجة
المؤلف:
Robert T. Morrison & Robert. N Boy
المصدر:
الكيمياء العضوية Organic chemistry
الجزء والصفحة:
p 348
30-3-2017
6833
الهدرجة. حرارة الهدرجة
Hydrogenation. Heat of hydrogenation
لقد رأينا سابقاً ان الهدرجة هي من اهم الطرائق المفيدة في تحضير الالكانات وهي ليست مقتصرة على اصطناع الالكانات ، ولكنها طريقة عامة لتحويل الرابطة المزدوجة. كربون – كربون غلى رابطة كربون – كربون احادية في اي نوع من المركبات التي صادفناها . يمكننا باستخدام نفيس الاجهزة، ونفس الحفاز، وتقريباً نفس الشروط ، تحويل الالكن إلى ألكان، والكحول غير المشبع إلى كحول مشبع، أو الاستر غير المشبع إلى استر مشبع. وبتغيير الحفاز والشروط، يمكننا اجراء هدرجة انتقائية على رابطة متعددة معينة دون الأخرى في نفس الجزيء ، على رابطة مزدوجة كربون – كربون ، ولكن ليس على الرابطة المزدوجة كربون – اكسجين ، او على رابطة ثلاثية ولكن ليس على رابطة مزدوجة، او حتى على رابطة مزدوجة كربون – كربون واحدة ولكن ليس على الأخرى، كما سنرى. ويمكننا تحويل مركب غير مشبع غير فعال ضوئياً إلى منتج فعال ضوئياً !
تكون الهدرجة عموماً على نوعين (أ) لا متجانسة (طوران) و(ب) متجانسة (طور واحد) . يقوم الحفاز في كلا الحالتين بإضافة جزيء هيدروجين H2 إلى الرابطة المزدوجة.
تعد الهدرجة اللامتجانسة heterogeneous hydrogenation الطريقة التقليدية الأوسع استخداماً. يكون الحفاز معدناً مجزأ إلى اجزاء دقيقة وعادة من البلاتين او البلاديوم او النيكل . يخض محلول من الالكن في ضغط منخفض من غاز الهيدروجين وبوجود كمية صغيرة من الحفاز، يحدث التفاعل بسرعة ويلطف، وعندما ينتهي، يرشح المنتج المشبع ببساطة لفصله عن الحفاز غير الذواب.
تقدم الهدرجة المتجانسة homogeneous hydrogenation الأحدث كثيراً مرونة ليست ممكنة في الحفازات القديمة. تجري الهدرجة عن طريق تطوير الحفازات بانتقائية لم يسبق لها مثيل . تكون الحفازات في هذه الحالة معقدات عضوية للمعادن الانتقالية مثل الروديوم والايرديوم: على سبيل المثال خفاز ولكنسن ، وهذه الحفازات ذوابة في المذيبات العضوية، وتحدث الهدرجة في طور واحد هو المحلول. والصعوبة التي تصادف في هذه الطريقة تكمن بفصل الحفاز عن المنتج بعد انتهاء التفاعل. على كل حال، يجري العمل على تطوير هذه الطريقة لحل هذه المشكلة: يرتبط الحفاز – كيميائياً – مع بوليمر صلب ذواب (جزيء ضخم) وبالتالي يسهل الترشيح في نهاية التفاعل. وهكذا تصبح الهدرجة المتجانسة غير متجانسة، مع بقاء على ما يبدو نفس طراز التأثير.
بما ان التفاعل كمي عموماً ، وبما انه يمكن تقدير حجم الهيدروجين المستهلك بسهولة، لذلك فمن المألوف ان يستخدم تفاعل الهدرجة وسيلة تحليلية. على سبيل المثال، يمكن أن يكشف لنا عن عدد الروابط المزدوجة في مركب ما.
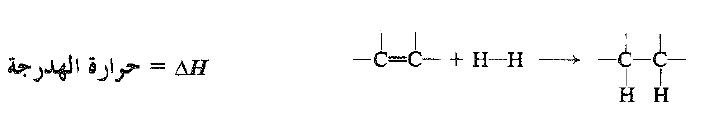
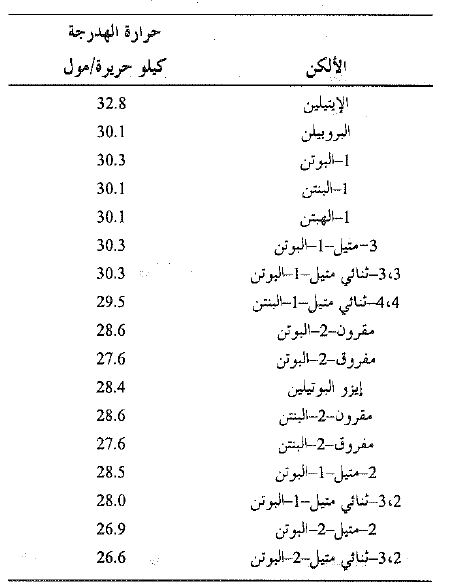
يكون تفاعل الهدرجة ناشراً للحرارة. تتشكل رابطتها σ ( C – H) والرابطة π المنكسرة . تدعى كمية الحرارة المنطلقة عندما يهدرج مول واحد من مركب غير مشبع حرارة الهدرجة، وهي ببساطة HΔ التفاعل، ولكن الاشارة السالبة غير متضمنة. تكون حرارة الهدرجة ف كل الكن قريبة من القيمة 30 كيلو حريرة لكل رابطة مزدوجة في المركب (انظر الجدول 1.1).
حتى وعلى الرغم من ان تفاعل الهدرجة ناشر للحرارة، فهو يحدث بسرعة مهملة عند غياب الحفاز، حتى في درجات حرارة مرتفعة. ولذلك يجب ان يمتلك التفاعل غير المحفز طاقة تنشيط كبيرة جداً. ويكون فعل الحفاز في تخفيض طاقة التنشيط (Eact) لكي يمكن للتفاعل أن يتقدم بسرعة في درجة حرارة الغرفة. وكما هو معروف لا يؤثر الحفاز في تغير الطاقة الكلية للتفاعل، وببساطة يخفض من قمة الطاقة بين المتفاعلات والمنتجات (انظر الشكل 1.1).
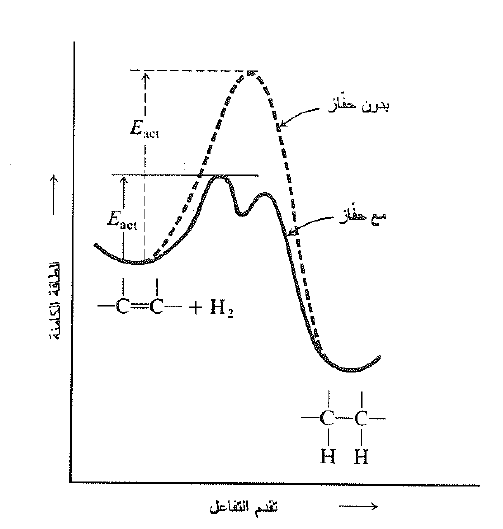
الشكل 1.1 تغير الطاقة الكامنة خلال تقدم التفاعل: تأثير الحفاز.
الجدول 1.1 : حرارات هدرجة الالكنات
يخفض الحفاز الــ Eact ويسمح للتفاعل بالحدوث وفق طريقة مختلفة، يعني، وفق آلية مختلفة. في هذه الحالة، تمتص المتفاعلات على سطح هائل |لأجزاء المعدن الصلب الدقيقة، او ترتب مبدئياً إلى أيونات المعدن المذابة.
ويختلف التفاعل تحت هذه الشروط كثيراً عن التفاعل الذي يمكن ان يحدث وفق طريقة اخرى. ويعتقد ، على سبيل المثال، ان سطح الحفاز الصلب يكسر الرابطة π في الالكن قبل التفاعل مع الهيدروجين. ويكسر ايون المعقد المعدني في الهدرجة المتجانسة الرابطة هيدروجين- هيدروجين وينقل الهيدروجينات إلى الرابطة المزدوجة واحداً تلو الآخر.
وكما نرى فإن تخفيض قمة الطاقة، تنقص طاقة تنشيط التفاعل المعاكس ايضاً، وبالتالي تزيد من سرعة نزع الهيدروجين. لذلك يمكن ان نتوقع ان الحفازات الصلبة البلاتين، البلاديوم والنيكل في شروط مناسبة تصلح ايضاً كحفازات لنزع الهيدروجين. وبالتأكيد فإن الامر هو كذلك. ونح ندرك بالطبع انه على الرغم من ان الحفاز يسرع التفاعل ولكنه لا يزيح موضع التوازن، ويعود ذلك بالطبع إلى زيادة سرعة كل من التفاعلين المباشر والعكسي.
تكون إضافة الكواشف الاخرى إلى الرابطة المزدوجة، عموماً، مثل الهدرجة ، ناشرة للحرارة . وتكون الطاقة المصروفة عند كسر الروابط Y – Z و π على الأغلب دائماً أقل من المتحررة من تشكل الروابط C – Y و C – Z.
 الاكثر قراءة في مواضيع عامة في الكيمياء العضوية
الاكثر قراءة في مواضيع عامة في الكيمياء العضوية
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة

الآخبار الصحية















 قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة
قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة "المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة
"المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة (نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)
(نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)


















