

علم الكيمياء

تاريخ الكيمياء والعلماء المشاهير

التحاضير والتجارب الكيميائية

المخاطر والوقاية في الكيمياء

اخرى

مقالات متنوعة في علم الكيمياء

كيمياء عامة


الكيمياء التحليلية

مواضيع عامة في الكيمياء التحليلية

التحليل النوعي والكمي

التحليل الآلي (الطيفي)

طرق الفصل والتنقية


الكيمياء الحياتية

مواضيع عامة في الكيمياء الحياتية

الكاربوهيدرات

الاحماض الامينية والبروتينات

الانزيمات

الدهون

الاحماض النووية

الفيتامينات والمرافقات الانزيمية

الهرمونات


الكيمياء العضوية

مواضيع عامة في الكيمياء العضوية

الهايدروكاربونات

المركبات الوسطية وميكانيكيات التفاعلات العضوية

التشخيص العضوي

تجارب وتفاعلات في الكيمياء العضوية


الكيمياء الفيزيائية

مواضيع عامة في الكيمياء الفيزيائية

الكيمياء الحرارية

حركية التفاعلات الكيميائية

الكيمياء الكهربائية


الكيمياء اللاعضوية

مواضيع عامة في الكيمياء اللاعضوية

الجدول الدوري وخواص العناصر

نظريات التآصر الكيميائي

كيمياء العناصر الانتقالية ومركباتها المعقدة


مواضيع اخرى في الكيمياء

كيمياء النانو

الكيمياء السريرية

الكيمياء الطبية والدوائية

كيمياء الاغذية والنواتج الطبيعية

الكيمياء الجنائية


الكيمياء الصناعية

البترو كيمياويات

الكيمياء الخضراء

كيمياء البيئة

كيمياء البوليمرات

مواضيع عامة في الكيمياء الصناعية

الكيمياء الاشعاعية والنووية
التفاعل SN2 التحفيز انتقالي الطور
المؤلف:
Robert T. Morrison & Robert. N Boy
المصدر:
الكيمياء العضوية Organic chemistry
الجزء والصفحة:
p 284 - 6th ed
5-3-2017
3340
التفاعل SN2 التحفيز انتقالي الطور
The SN2 reaction: phase – transfer catalysis
عند التحول من مذيب بروتوني إلى مذيب لا بروتوني ، نكون قد خطونا خطوة في اتجاه وسط التفاعل SN2 المثالي: في الطور الغازي، حيث يكون الانيون غير معاق بشكل كامل وشديد التفاعلية. مع ذلك، وحتى المذيب اللابروتوني يستطيع ان يذوب الانيونات، فهو قطبي، وبشكل روابط ايون – ثنائي قطب . ويمكن ان نتصور، من وجهة نظر تفاعلية النوكليوفيل فقط، ان المذيب المثالي يجب ان يكون منخفض القطبية جداً مثل هيدروكربون أو هاليد عضوي : مثلاً البنزين (C6H6) أو كلوريد المبتلين (CH2Cl2). ولكن الغاية من المذيب هي جعل المتفاعلات تتلامس، فالركيزة العضوية تتذوب في مثل هذا المذيب، ولكن الكاشف الايوني لن يذوب. وتبدو هذه المسألة – مثل الكاشف – غير قابلة للحل. ولكن هل هي كذلك؟
خذ على سبيل المثال ، التفاعل بين هاليد الالكيل وسيانيد الصوديوم. يكون اليانيد قوي الاساسية ، فهو انيون نوكليوفيلي، ويحب محل الهاليد ليعطي الالكيل سبانيد او النتريل. ان الطريقة التقليدية لإجراء هذا التفاعل هي استخدام مذيب – بروتوني أو لا بروتوني – قادر على تذويب كلا الكاشفين.
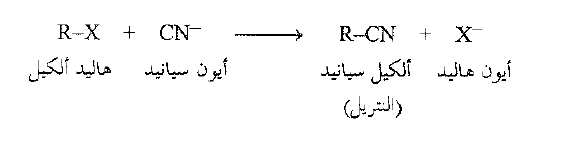
عوضاً عن ذلك، لنفرض لدينا محلولاً من هاليد الكيل في مذيب عضوي لا قطبي ومحلولاً من سبانيد الصوديوم في الماء، واننا مزيجنا المحلولين معاً. لا تمتزج المذيبات المستخدمة وتشكل طبقتين – طورين . يمكننا تسخين هذا المزيج فترة طويلة، ولكن لن يحدث اي شيء تبقى الركيزة في الطبقة العضوية ويبقى النوكليوفيل في الطبقة المالية، ولا يفعلان ما هو مطلوب فعله ، إذا كان المطلوب هو حدوث تفاعل لأن المواد المتفاعلة لا تستطيع ان تتصادم.
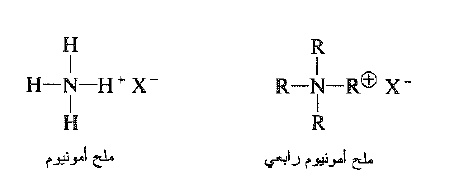
إذا أضفنا عندئذ، إلى هذا المزيج كمية صغيرة من ملح امونيوم رابعي: مركب استبلت بهيدروجينات ايون الامونيوم فيه زمر الكليلية – متيل او من الافضل زمر نظامي البوتيل . وللتبسيط فإننا سوف نسمي هذا الكاتيون الرابعي (Q+). لكي نجعل الامور واضحة، فإن الانيون في هذا الملح سيكون هو البيسلفات – HSO4.
والآن، يحدث أمر مدهش: فبوجود كمية محفزة من هذه الملح الرابعي، بتفاعل هاليد الالكيل والسيانيد – يبدو طاهرياً ان كلاً منهما ما زال منفصلاً في طوره – بسرعة في شروط معتلدة ليعطي مردوداً عالياً من النتريل.
يعد هذا الحدث مثالاً عما قدمه شارلز م. ستاركز Charles M. Starks (شركة زيت دولية) أحد رواد هذا المجال، وسمي التحفيز انتقالي الطور. والآن، كيف يتحقق بالضبط ؟ لخص ستاركز الدورة الحفزية كما هو موضح في الشكل 1.1 يتوقف كل شيء على حقيقة ان زمر الالكيل في الايون الرابعي تجعله محباً للشحم ، وبالتالي قادراً على الدخول في الطور العضوي. لكنها لا تستطيع الذهاب وحدها، لتوازن شحنتها الموجبة فيجب ان تأخذ معها الانيون. احياناً يكون هذا الانيون الايون المعاكس الاصلي : البيسلفات ، لا يملك هذا الانيون الضعيف عملياً اي قوة نوكليوفيلية، ولا يفعل شيئاً.
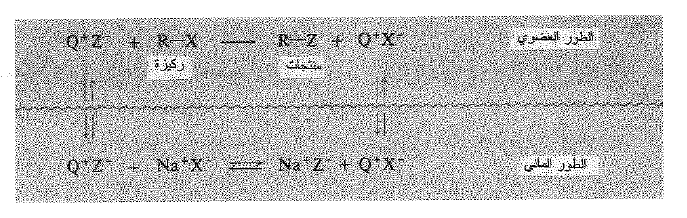
الشكل 1.1 : التحفيز انتقالي الطور. يملك ايون الامونيوم الرابعي خاصيتي المحب للماء والمحب للشحم. يتردد جينة النوكليوفيل في الطور العضوي عملياً غير مذوب ويتفاعل بسرعة مع الركيزة (R-X).
لكن معظم الايونات في الطور المائي هي ايونات السبانيد (أو اي نوع من النوكليوفيل المستخدم) وهي الأكثر احتمالاً ان تنتقل إلى الطور العضوي. لدينا الآن ايونات سيانيد في وسط غير محتمل ابداً : مذيب لا قطبي . وقد يكون تركيزها فيه صغيراً جداً، ولكنها تكون عملياً غير مذوبة وعالية التفاعلية . ويحدث الاستبدال بسرعة فيتشكل النتريل ويتحرر ايون الهاليد. ينقل ايون الهاليد إلى الطور المائي بوساطة الايون الرابعي عند عودته من رحلته. وهكذا يستمر التفاعل حيث ينتقل الايون الرابعي جيئة وذهاباً بين الطورين آخذاً معه الانيونات : تارة الايون المعاكس الاصلي، وتارة اخرى احذ أيونات الهاليد المزاحة، واحياناً النوكليوفيل، ايون السبانيد. وعندما يحصل ذلك اخيراً يحدث التفاعل لذلك، يكون التحفيز نتيجة انتقال النوكليوفيل من طور إلى آخر.
هنالك عامل آخر يكون ذا صلة هنا. كما رأينا سابقاً توجد الأملاح في معظم المذيبات إلى حد ما على شكل ازواج ايونية. يتحسس الايون الشحنة المعاكسة لأيونه وينجذب إليه، وكلما كان المذيب أقل قطبية – اي اخفض تذويباً – يكون الزوجان الايونيان اقوى ، تستبدل رابطة معينة بأخرى. يميل هذا التجاذب الكهربائي التحول إلى مذيب لا قطبي فإننا ببساطة فتستبدل نوعاً من التخميل بآخر ، لكننا نجد هنا ميزة اخرى للأيون الرابعي بصفته حفازاً انتقالي الطور. تكون زمر الالكيل التي تجعله محباً للشحم زمراً كبيرة تحجب الانيون من الشحنة الموجبة على النتروجين (انظر الشكل 1.2). ويكون الانيون منجذباً بقوة اضعف إلى هذه الشحنة المدفوعة داخل الايون الرابعي من الشحنة المركزة على الكاتيون المعدني . يكون الزوجان الايونيان غير مرتبطين بإحكام ويصبح الانيون نسبياً حراً وعالي التفاعلية.

الشكل 1.2 : البنية الجزيئية والخواص الفيزيائية : الذوبانية ، النماذج : (أ) ايون الامونيوم NH4+ (ب) ايون رباعي متيل الامونيوم (CH3)4N+ الزمر الأربع المحبة للشحم في (ب) تجعل الأيون ذواباً في المذيبات العضوية. بنفس الوقت، فإنها تحجب الشحنة الموجبة عن النتروجين والشحنة السالبة عن الايون المعاكس، وبالتالي تخفض التزاوج الايوني حتى الحد الادنى.
ترجع قوة التحفيز انتقالي الطور إلى انها تخفض القوتين الرئسيتين المحملتين للأنيون: التذوب والتزاوج الايوني وهنالك وجوه كثيرة للطريقة. فليس هناك حاجة لوجود طور مائي: يمكن للسبانيد ان ينتقل إلى الطور العضوي مباشرة من سيانيد الصوديوم الصعب. ولا حاجة لإضافة مذيب عضوي: فالركيزة نفسها، إذا كانت سائلة، يمكن أن تقوم بدور المذيب، ولا ضرورة لأن يكون عامل انتقالي الطور أيونياً، إذ يمكن عوضاً عن ذلك جزيئاً معتدلاً، ومن اهم هذه المحفزات المعتدلة، كما سنجد، الانيرات التاجية والتي بدراستها يمكن ان ندخل مجالاً ساحراً من العلاقات المفيدة جداً .
وفي اشكاله المختلفة بدأ التحفيز انتقالي الطور ثورة تقنية في طريقة إجراء التفاعلات الكيميائية : في المختبر وفي المصنع: ليس فقط الاستبدال النوكليوفيلي، ولكن تفاعلات الحذف والإضافة والأكسدة والإرجاع، لقد أعطت الكيميائي العضوي اداة جديدة قوية لمساعدته على الوصول إلى هدفه الرئيس : وهو التحكم في التفاعل العضوي.
 الاكثر قراءة في مواضيع عامة في الكيمياء العضوية
الاكثر قراءة في مواضيع عامة في الكيمياء العضوية
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة

الآخبار الصحية















 قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة
قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة "المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة
"المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة (نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)
(نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)


















