

علم الكيمياء

تاريخ الكيمياء والعلماء المشاهير

التحاضير والتجارب الكيميائية

المخاطر والوقاية في الكيمياء

اخرى

مقالات متنوعة في علم الكيمياء

كيمياء عامة


الكيمياء التحليلية

مواضيع عامة في الكيمياء التحليلية

التحليل النوعي والكمي

التحليل الآلي (الطيفي)

طرق الفصل والتنقية


الكيمياء الحياتية

مواضيع عامة في الكيمياء الحياتية

الكاربوهيدرات

الاحماض الامينية والبروتينات

الانزيمات

الدهون

الاحماض النووية

الفيتامينات والمرافقات الانزيمية

الهرمونات


الكيمياء العضوية

مواضيع عامة في الكيمياء العضوية

الهايدروكاربونات

المركبات الوسطية وميكانيكيات التفاعلات العضوية

التشخيص العضوي

تجارب وتفاعلات في الكيمياء العضوية


الكيمياء الفيزيائية

مواضيع عامة في الكيمياء الفيزيائية

الكيمياء الحرارية

حركية التفاعلات الكيميائية

الكيمياء الكهربائية


الكيمياء اللاعضوية

مواضيع عامة في الكيمياء اللاعضوية

الجدول الدوري وخواص العناصر

نظريات التآصر الكيميائي

كيمياء العناصر الانتقالية ومركباتها المعقدة


مواضيع اخرى في الكيمياء

كيمياء النانو

الكيمياء السريرية

الكيمياء الطبية والدوائية

كيمياء الاغذية والنواتج الطبيعية

الكيمياء الجنائية


الكيمياء الصناعية

البترو كيمياويات

الكيمياء الخضراء

كيمياء البيئة

كيمياء البوليمرات

مواضيع عامة في الكيمياء الصناعية

الكيمياء الاشعاعية والنووية
طبيعة الأحماض الامينية
المؤلف:
أ.د.عيسى عبد السعداوي
المصدر:
الكيمياء الحيوية النظري
الجزء والصفحة:
ص141-148
29-2-2016
26367
طبيعة الأحماض الامينية :
ان انتظام المجاميع الأربعة في الاحماض الامينية حول ذرة الكربون (ألفا) تكسب الحامض الأميني نشاطاً ضوئياً، فجميع الأحماض الامينية العشرون عدا حامض الكلايسين (Gly) تعطي انداداً بصرية بسبب امتلاكها ذرة كربون غير متناسقة (كيرالية) لذلك فان هذه الاحماض توجد في الطبيعة على شكلين، الشكل الأول يسمى L- أيزومير (L – isomer) والثاني يسمى – D - أيزومير (D- isomer).
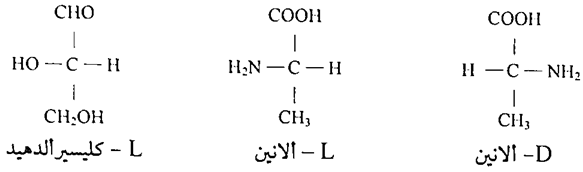

وتتكون عادة كل البروتينات في جسم الإنسان من الاحماض الامينية شكل (L). ان العشرين حامض أميني الداخلة في تركيب البروتينات تمتلك سلاسلا جانبية مختلفة في الشكل والحجم والشحنة والتركيب الكيميائي. ان البروتينات في جميع الاجناس من البكتريا حتى الإنسان تتألف من نفس مجموعة العشرون حامض أميني.
ان الاساسيات الأبجدية للجزيئات البروتينية يرجع عمرها الى ما لا يقل عن بليون سنة. وهذا الطيف من التنوع في الوظائف التي تؤديها الجزيئات البروتينية ناتج عن الاختلاف والتنوع في استثمار العشرين نوعاً من الاحماض الامينية في تشكيل الجزيئات البروتينية.
وسوف نلقي نظرة موجزة عن هذه الاحماض الامينية من حيث الطبيعة الكيميائية والمجاميع الجانبية وبيان مدى تأثيرها على الصفات الكيميائية والفيزيائية لهذه الاحماض والتي تعتبر الوحدات الأساسية في تشكيل كافة الجزيئات البروتينية المعروفة :
- ان أبسط أنواع هذه الاحماض هو حامض الكلايسين والذي له ذرة هيدروجين تمثل السلسلة الجانبية، ثم يليه الآلانين وله مجموعة مثيل تمثل السلسلة الجانبية. وتوجد سلسلة جانبية هيدروكاربونية أكبر حجماً مكونة من ثلاثة أو أربعة ذرات من الكربون. ففي أحماض الفالين (Val)، وحامض الليوسين (Leu)، وحامض الأيسوليوسين (Ile)، تكون السلاسل الأليفاتية الكبيرة نوعاً ما نابذة (كارهة) للماء، بمعنى أنها تحبذ التجمع فيما بينها مبتعدة عن جزيئات الماء في المحيط. وان التركيب الثلاثي للبروتينات الذائبة في الماء يصبح مستقرا باقتراب السلاسل الجانبية الكارهة للماء من بعضها لتحاشي الالتصاق بالماء.

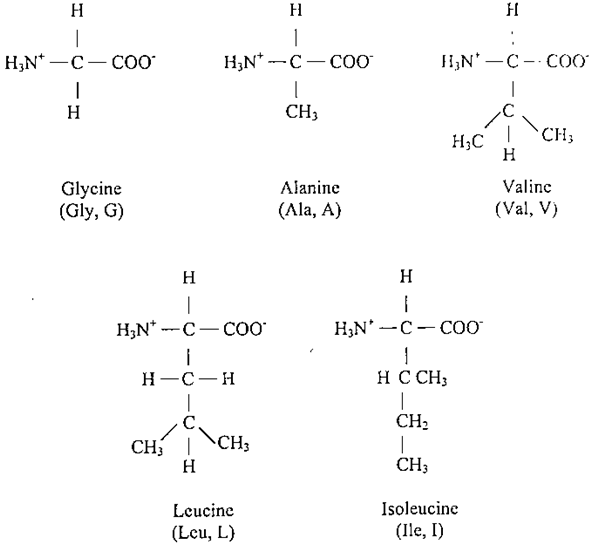
ان اختلاف السلاسل الجانبية الهيدروكاربونية في الجسم والشكل يمكنها من التراص معاً لتكوين مركبات محبوكة التركيب يتخللها قليل من المساحات البينية الصغيرة.
ان حامض البرولين (Pro , P) هو الآخر يحتوي على سلاسل جانبية اليفانية ولكنها تختلف عن باقي أعضاء المجموعة العشرين في كون سلسلته الجانبية مرتبطة بكل من ذرة النتروجين للمجموعة الأمينية وذرة الكربون (ألفا)، والمركب الحلقي الناتج يؤثر في الشكل البنائي الهندسي للجزيئات البروتينية. وغالبا ما نرى البرولين موجودا عند الالتواء في الجزيئات البروتينية المطوية وهو غير كاره للماء، ويلاحظ كذلك ان البرولين (Proline) يحتوي على مجموعة أمينية ثنائية الارتباط وليست أولية الارتباط، مما يجعله حامضا أمينياً من نوع (lmino Acid).

- هنالك ثلاثة أحماض أمينية لها سلاسل جانبية أروماتية، وهي جزء من المجموعة الأساسية، فحامض الفنيل ألانين (Phenyl alanine) يحتوي على حلقة بنزين (فنيل) متصلة بمجموعة ميثيلين (-CH2-) وحامض التريتوفان (Tryptophan) يحتوي على حلقة أندول متصلة بمجموعة ميثيلين، وهذه السلسلة الجانبية تحتوي على ذرة نتروجين بالإضافة الى ذرات الكربون والهيدروجيني. ان الفنيل ألانين والتربتوفان شديدا لنفور من الماء. اما الحامض الثالث وهو التايروسين (Tyrosine) فيحتوي على مجموعة هيدروكسيل والتي تجعل التايروسين أقل نفوراً من الماء بالمقارنة مع الحامضين السابقين.

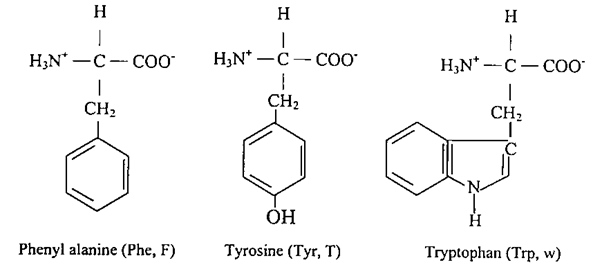
ان الاحماض الامينية التي تم التطرق إليها حتى الان تحتوي على الحلقة الأروماتية مثل الفنيل آلانين والتربتوفان والتايروسين التي لها القدرة على سحب الإلكترون (باي Pi – electron-) العديمة التوضع يجعلها قادرة على التفاعل مع النظم – باي (Pi – System) الأخرى وتستطيع نقل الإلكترونات.
- كما ان هنالك احماض المينية تمتلك سلاسلها الجانبية على ذرة الكبريت (Sulphur) وهما حامض السستين (Cysteine) الحاوي على ذرة الكبريت في رابطة أيثرية كبريتيدية (CH3-S-) وكلتا السلسلتين الجانبيتين المحتويتين على الكبريت نافرة من الماء (كارهة له) ومجموعة السلفاهيدريل في السستين نشطة جداً.


- كما يوجد لدينا حامضان أمينيان يحتويان على مجموعة هيدروكسيل ألفاتية، وهما السيرين (Serine) والثريونين (Threonine). ان هذين الحامضين يمكن اعتبارهما الشكل الهيدروكسيلي للألانين والفالين على التوالي، وان وجود هذه المجموعة تجعلها أكثر تقلباً للماء واكثر نشاطا من الألانين والفالين. لحامض الثريونين مركزين لعدم التناظر (Asymmetry) وهو بذلك يشبه حامض الأيسوليوسين.


نعاود مرة اخرى جولتنا في الاحماض الامينية ونتكلم عن :
- الأحماض الامينية ذات المجاميع الجانبية الشديدة القطبية : لهذه الاحماض الامينية ميلا شديدا نحو الماء، فحامض اللايسين (Lysine)، وحامض الأرجنين (Arginine) يحملان شحنات موجبة عند الدرجة المتعادلة، كما ان حامض الهستيدين يمكن ان يكون غير مشحون او يحمل شحنة موجبة تبعاً للبيئة التي تحيط به. وكما هو معروف فإن الهستيدين يوجد في مواقع النشاط في المركبات الأنزيمية، حيث ان حلقة الأميازول لها القدرة على التنقل بين الحالة المتعادلة او الموجبة لتساعد على تكوين الروابط او تكسيرها.

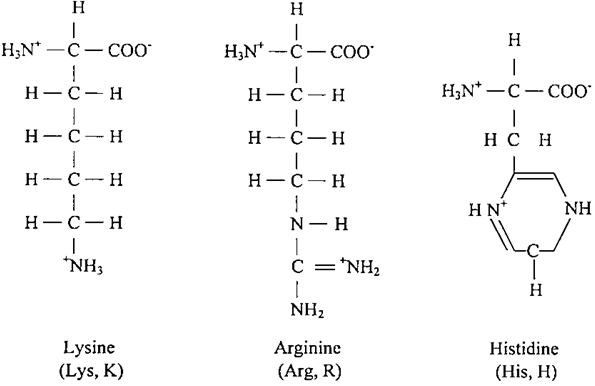
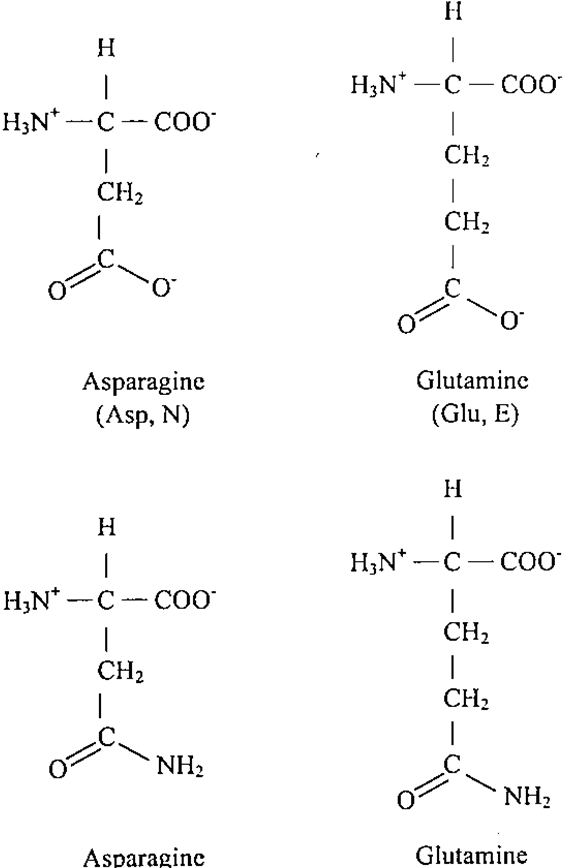
- ان حامضي الأسبارتيك (Aspartic Acid) وحامض الكلوتاميك (Glutamic Acid) يعتبران من الاحماض الامينية الحامضية لامتلاكها على مجموعة جانبية حامضية، وغالبا ما يطلق اسبرتات وكلوتامات، للتأكيد على ان السلسلة الجانبية تحمل شحنة سالبة عند الأس الهيدروجيني الفسيولوجي السالب. ان لهذين الحامضين مشتقة عديمة الشحنة تتمثل في الكلوتامين والأسباراجين اللذين يحتويان على مجموعة أميدية طرفية حلت محل مجموعة الكربوكسيل.

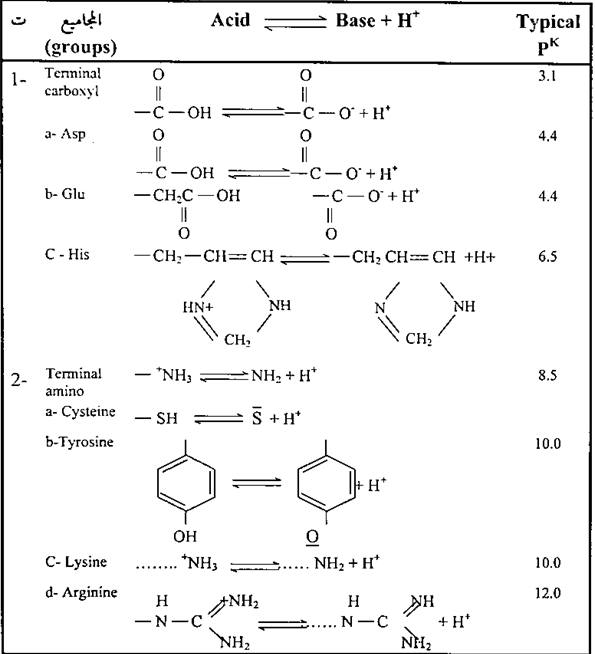
مما سبق نلاحظ ان سبعة أحماض من العشرين حامض أميني لها سلاسل جانبية قابلة للتأين وقد تم توضيح ذلك في قيم التوازن، Pk (ثابت التأين) للسلاسل الجانبية للأرجننين، واللايسين، والهستدين، والإسبارتيك، والكلوتاميك والستين والتايروسين في البروتينات في الجدول التالي :
 الاكثر قراءة في الاحماض الامينية والبروتينات
الاكثر قراءة في الاحماض الامينية والبروتينات
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة

الآخبار الصحية















 قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة
قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة "المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة
"المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة (نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)
(نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)


















