

علم الكيمياء

تاريخ الكيمياء والعلماء المشاهير

التحاضير والتجارب الكيميائية

المخاطر والوقاية في الكيمياء

اخرى

مقالات متنوعة في علم الكيمياء

كيمياء عامة


الكيمياء التحليلية

مواضيع عامة في الكيمياء التحليلية

التحليل النوعي والكمي

التحليل الآلي (الطيفي)

طرق الفصل والتنقية


الكيمياء الحياتية

مواضيع عامة في الكيمياء الحياتية

الكاربوهيدرات

الاحماض الامينية والبروتينات

الانزيمات

الدهون

الاحماض النووية

الفيتامينات والمرافقات الانزيمية

الهرمونات


الكيمياء العضوية

مواضيع عامة في الكيمياء العضوية

الهايدروكاربونات

المركبات الوسطية وميكانيكيات التفاعلات العضوية

التشخيص العضوي

تجارب وتفاعلات في الكيمياء العضوية


الكيمياء الفيزيائية

مواضيع عامة في الكيمياء الفيزيائية

الكيمياء الحرارية

حركية التفاعلات الكيميائية

الكيمياء الكهربائية


الكيمياء اللاعضوية

مواضيع عامة في الكيمياء اللاعضوية

الجدول الدوري وخواص العناصر

نظريات التآصر الكيميائي

كيمياء العناصر الانتقالية ومركباتها المعقدة


مواضيع اخرى في الكيمياء

كيمياء النانو

الكيمياء السريرية

الكيمياء الطبية والدوائية

كيمياء الاغذية والنواتج الطبيعية

الكيمياء الجنائية


الكيمياء الصناعية

البترو كيمياويات

الكيمياء الخضراء

كيمياء البيئة

كيمياء البوليمرات

مواضيع عامة في الكيمياء الصناعية

الكيمياء الاشعاعية والنووية
تبدي جزيئات الماء ميلا ضعيفا للتفكك ، لكنه في غاية الاهمية فيزيولوجيا
المؤلف:
د. روبرت موراي وآخرون
المصدر:
هاربرز في الكيمياء الحيوية
الجزء والصفحة:
ص 56
30-3-2021
3782
تبدي جزيئات الماء ميلا ضعيفا للتفكك ، لكنه في غاية الاهمية فيزيولوجيا
إن لقابلية الماء للتأين (Ionize)، رغم ضعفها ، أهمية مركزية بالنسبة للحياة على الأرض . وبما أن الماء يستطيع العمل كحمض كأساس ، فمن الممكن تصور تأينه على أنه تناقل بروتون بين الجزيئات ليتشكل أيون الهيدرونيوم (+H3O) وأيون الهيدروكسيد OH كما يلي:

وفي حقيقة الأمر فإن البروتون يرتبط مع مجموعة من جزيئات الماء، وهو لا يوجد في المحلول على شكل +H3O، بل بشكل أقرب إلى +H5O2 أو+H7O3 ومع ذلك فإننا، ولأهداف عملية، نكتب هذا البروتون " المجرد " ظاهرياً على شكل +H مع الأخذ بعين الاعتبار ألا ننسى أنه في الحقيقة مميه (Hydrated) بشدة.
وبما أن الأيونات تعاود الاتحاد باستمرار لتشكل جزيئات الماء ، والعكس بالعكس، فمن غير الممكن أن نقرر فيما إذا كانت ذرة هيدروجين أو أكسجين موجودة كأيون أم أنها ضمن جزيء الماء ، فهي أيون حينا وجزء من الماء حينا آخر ، وليس من الضروري، ولحسن الحظ ، أن ندرس الجزيئات أو الأيونات بشكل منفرد. وبما أن جراماً واحداً من الماء يحوي 3.46 × 1022 جزيئا ، فإنه من الممكن وصف تأين الماء إحصائيا ، ويكفي أن نعرف ما مدى احتمال وجود الهيدروجين كأيون أو كجزء من الماء.
وعندما نقول أن احتمال وجود الهيدروجين كأيون هو 0.10 ، فهذا يعني أن لذرة الهيدروجين فرصة واحدة من مائة فرصة لتكون أيونا و 99 فرصة من مائة لتكون ضمن جزيء ماء. والاحتمال الحقيقي لوجود الهيدروجين كأيون في الماء النقي يساوي تقريبا 0.000000018 أو 1.8× 9-10، وبالتالي ، فإن احتمال وجودها كجزء من الماء يساوي تقويبا 100%.
وبطريقة أخرى ، فإنه في مقابل كل أيون (Ion) هيدروجين أو هيدروكسيل في الماء النقي، يوجد 1.8 بليون ( أو 1.8 × 109 جزيئاً من الماء ؛ ومع ذلك فإن لايونات الهيدروجين والهيدروكسيل أثر كبير ومهم على خصائص الماء.
تحسب ثابتة تفاعل تفارق الماء (Dissociation constant) التي يرمز لها بالرمز K كما يلي :

بحيث تمثل التعابير المحاطة بقوسين التركيز الجزيئي لأيونات الهيدروجين والهيدروكسيل وجزيئات الماء غير المتأينة ™. ولحساب K رقميا ، نذكو أن وزن جزيء واحد من الماء هو 18 ج ، وبالتالي فإن ليترا من الماء ( 1000جم) يحوي 1000 / 18 = 55.56 مول ( أي أن التركيز الجزيئي للماء النقي هو 55.65 جزيء /ل). وبما أن احتمال وجود الهيدروجين على شكل أيون في الماء النقي هو 1.8 × 10-9، فإذا ضربنا نسبة الاحمال بالتركيز الجزيئي للماء ستحصل على التركيز الجزيئي لأيونات الهيدروجين أو (أيونات الهيدروكسيل) في الماء النقي وهو 1 × 10-7 مول / ل.
ونستطيع الآن حساب K بالنسبة للماء كما يلي:

وبنظرة متفحصة لهذه الأرقام نجد ان تركيز جزيئات الماء العالي (55.56 مول /ل) (mol/l) لا يتأثر بشكل ملحوظ بالتفارق ، وبالتالي فإن من الممكن الاتفاق على اعتباره ثابتا ودمجه بالثابتة K لنحصل على ثابتة جديدة تدعى الناتج الايوني للماء (lon product of water) ويرمز له بالرمز Kw ، وتتضح العلاقة بين K و Kw كما يلي:
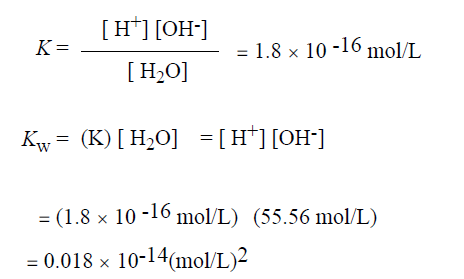
نؤكد هنا على ان المقصود بالتعابير المحاطة بقوسين هو النشاط الجزيئي وليس التركيز الجزيئي.
لاحظ ان قيمة K تقدر بالمول / ل ، بينما تقدر قيمة Kw بالمول 2 /ل2، وكما يوحي اسمه ، فالناتج الايوني للماء Kw يساوي رقميا ناتج التراكيز الجزيئية لأيونات الهيدروجين والهيدروكسيل :
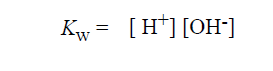
إن قيمة الثابتة Kw في درجة الحرارة o25 م تساوي (10-7)2 أي 10-14 (مول/ل)2، وترتفع هذه القيمة بارتفاع درجة الحرارة وتنخفض بانخفاضها ؛ فعلى سبيل المثال، يكون تركيز أيونات الهيدروجين في الماء النقي في درجة الحرارة المعادلة لدرجة حرارة جسم الإنسان أعلى قليلا من 10-7 جزيء / ل. وضمن مدى التأثيرات المحدودة لمجال درجات الحرارة، تبقى Kw تساوي 10-14 (مول/ل)2في كل المحاليل المائية حتى الحاوية منها على أحماض أو قواعد (أسس). وسنستخدم هذه القيمة لحساب قيم باهاء (pH) للمحاليل الحمضية والقاعدية القلوية).
 الاكثر قراءة في مواضيع عامة في الكيمياء الحياتية
الاكثر قراءة في مواضيع عامة في الكيمياء الحياتية
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة

الآخبار الصحية















 قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة
قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة "المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة
"المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة (نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)
(نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)


















