
تاريخ الفيزياء

علماء الفيزياء


الفيزياء الكلاسيكية

الميكانيك

الديناميكا الحرارية


الكهربائية والمغناطيسية

الكهربائية

المغناطيسية

الكهرومغناطيسية


علم البصريات

تاريخ علم البصريات

الضوء

مواضيع عامة في علم البصريات

الصوت


الفيزياء الحديثة


النظرية النسبية

النظرية النسبية الخاصة

النظرية النسبية العامة

مواضيع عامة في النظرية النسبية

ميكانيكا الكم

الفيزياء الذرية

الفيزياء الجزيئية


الفيزياء النووية

مواضيع عامة في الفيزياء النووية

النشاط الاشعاعي


فيزياء الحالة الصلبة

الموصلات

أشباه الموصلات

العوازل

مواضيع عامة في الفيزياء الصلبة

فيزياء الجوامد


الليزر

أنواع الليزر

بعض تطبيقات الليزر

مواضيع عامة في الليزر


علم الفلك

تاريخ وعلماء علم الفلك

الثقوب السوداء


المجموعة الشمسية

الشمس

كوكب عطارد

كوكب الزهرة

كوكب الأرض

كوكب المريخ

كوكب المشتري

كوكب زحل

كوكب أورانوس

كوكب نبتون

كوكب بلوتو

القمر

كواكب ومواضيع اخرى

مواضيع عامة في علم الفلك

النجوم

البلازما

الألكترونيات

خواص المادة


الطاقة البديلة

الطاقة الشمسية

مواضيع عامة في الطاقة البديلة

المد والجزر

فيزياء الجسيمات


الفيزياء والعلوم الأخرى

الفيزياء الكيميائية

الفيزياء الرياضية

الفيزياء الحيوية

الفيزياء العامة


مواضيع عامة في الفيزياء

تجارب فيزيائية

مصطلحات وتعاريف فيزيائية

وحدات القياس الفيزيائية

طرائف الفيزياء

مواضيع اخرى
Clausius–Clapeyron
المؤلف:
Sidney B. Cahn, Gerald D. Mahan And Boris E. Nadgorny
المصدر:
A GUIDE TO PHYSICS PROBLEMS
الجزء والصفحة:
part 2 , p 29
25-8-2016
1175
Clausius–Clapeyron
a) Derive the Clausius–Clapeyron equation for the equilibrium of two phases of a substance. Consider a liquid or solid phase in equilibrium with its vapor.
b) Using part (a) and the ideal gas law for the vapor phase, show that the vapor pressure follows the equation ln PV = A – B/τ. Make reasonable assumptions as required. What is B?
SOLUTION
a) We know that, at equilibrium, the chemical potentials of two phases should be equal:
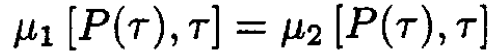 (1)
(1)
Here we write P ≡ P(τ) to emphasize the fact that the pressure depends on the temperature. By taking the derivative of (1) with respect to temperature, we obtain
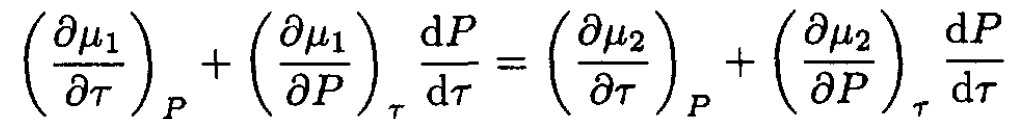 (2)
(2)
Taking into account that (∂μ/∂τ)p = -s and (∂μ/∂P)τ = v, where s and v are the entropy and volume per particle, and substituting into (2), we have
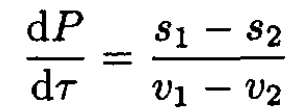 (3)
(3)
where subscripts 1 and 2 refer to the two phases. On the other hand, q = τ(s2 – s1), where q is the latent heat per particle, so we can rewrite (3) in the form
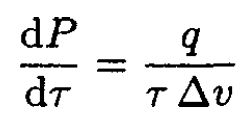 (4)
(4)
which is the Clausius–Clapeyron equation.
b) Consider the particular case of equilibrium between liquid and vapor. The volume v1 of the liquid is usually much smaller than that for the vapor v2, so we can disregard v1 in (4) and write
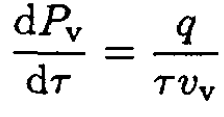 (5)
(5)
Using the ideal gas law for vapor, vv = τ/Pv, we get
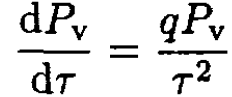 (5)
(5)
or
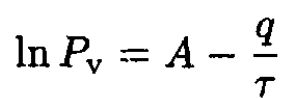 (6)
(6)
We can see that B = q. Rewriting (6) in usual units gives
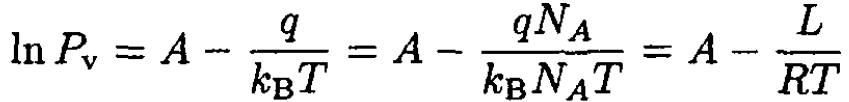
where L is the latent heat per mole, NA is Avogadro’s number, and R is the gas constant.