
تاريخ الفيزياء

علماء الفيزياء


الفيزياء الكلاسيكية

الميكانيك

الديناميكا الحرارية


الكهربائية والمغناطيسية

الكهربائية

المغناطيسية

الكهرومغناطيسية


علم البصريات

تاريخ علم البصريات

الضوء

مواضيع عامة في علم البصريات

الصوت


الفيزياء الحديثة


النظرية النسبية

النظرية النسبية الخاصة

النظرية النسبية العامة

مواضيع عامة في النظرية النسبية

ميكانيكا الكم

الفيزياء الذرية

الفيزياء الجزيئية


الفيزياء النووية

مواضيع عامة في الفيزياء النووية

النشاط الاشعاعي


فيزياء الحالة الصلبة

الموصلات

أشباه الموصلات

العوازل

مواضيع عامة في الفيزياء الصلبة

فيزياء الجوامد


الليزر

أنواع الليزر

بعض تطبيقات الليزر

مواضيع عامة في الليزر


علم الفلك

تاريخ وعلماء علم الفلك

الثقوب السوداء


المجموعة الشمسية

الشمس

كوكب عطارد

كوكب الزهرة

كوكب الأرض

كوكب المريخ

كوكب المشتري

كوكب زحل

كوكب أورانوس

كوكب نبتون

كوكب بلوتو

القمر

كواكب ومواضيع اخرى

مواضيع عامة في علم الفلك

النجوم

البلازما

الألكترونيات

خواص المادة


الطاقة البديلة

الطاقة الشمسية

مواضيع عامة في الطاقة البديلة

المد والجزر

فيزياء الجسيمات


الفيزياء والعلوم الأخرى

الفيزياء الكيميائية

الفيزياء الرياضية

الفيزياء الحيوية

الفيزياء العامة


مواضيع عامة في الفيزياء

تجارب فيزيائية

مصطلحات وتعاريف فيزيائية

وحدات القياس الفيزيائية

طرائف الفيزياء

مواضيع اخرى
انبعاث الضوء من الهيدروجين
المؤلف:
فريدريك بوش ، دافيد جيرد
المصدر:
اساسيات الفيزياء
الجزء والصفحة:
ص 1044
10-7-2016
13204
انبعاث الضوء من الهيدروجين
تتواجد ذرات الهيدروجين عادة في أدنى حالات الطاقة عندما n = 1! ويقال عنها عندئذ إنها غير مستثارة. إلا أنك إذا قذفت الذرات بجسيمات كالإلكترونات أو البروتونات، فإن التصادمات كفيلة باستثارتها. وبعبارة أخرى قد يمد التصادم الذرة بما يكفى من الطاقة لنقلها من الحالة الأرضية إلى حالة مستقرة أعلى.
وفرق الطاقة بين الحالتين n = 1 و n =2 ، كما هو واضح من الشكل (1) بالنسبة للهيدروجين هو:
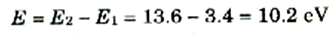
أي أن الجسم المقذوف لابد أن تكون لديه طاقة مقدارها 10.2 eV حتى يتمكن من استثارة الذرة من الحالة n =1 إلى الحالة n = 2. وبنفس الطريقة نجد انه لاستثارة الذرة من الحالة n =1 إلى الحالة n =3 تلزم طاقة مقدارها.


الشكل 1)): الرسم البياني لمستويات طاقة الهيدروجين. هناك عدد لا نهائي من المستويات فيما بين n = 4 و n = ∞.
ومن الطرق الشائعة لاستثارة ذرات غاز ما (راجع الشكل 2))) أن نطبق عليه فرق جهد مرتفع وهو تحت ضغط منخفض. ويحتوي الغاز عادة إلى قليل من الإلكترونات الحرة والأيونات ، ويتم تعجيل هذه الإلكترونات والأيونات في فرق الجهد فتتصادم مع ذرات الغاز مولدة بهذا انهماراً من الجسيمات المشحونة. ويصبح الغاز فتتصادم مع ذرات الغاز مولدة بهذا انهماراً من الجسيمات المشحونة. ويصبح الغاز في الأنبوبة ــ التي تسمى أنبوبة تفريغ ــ محتوياً على عدد الكبير من الذرات المؤينة والمستثارة إلى درجة كبيرة. ومن النماذج على تلك الأنابيب مصابيح إعلانات غاز النيون ومصابيح الفلورسنت. ولعلك تعلم أن تلك الأنابيب تنتج ألواناً مميزة للأضواء. وسنوضح فيما يلي السبب في أن أنبوبة تفريغ غاز الهيدروجين لابد أن ينبعث منها الضوء.
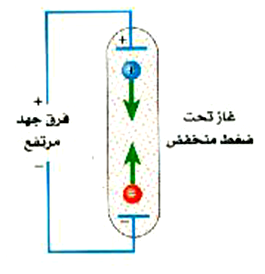
الشكل :(2) يقوم بفرق الجهد المرتفع عبر أنبوبة التفريغ يجعل الإلكترونات الحرة والأيونات تتحرك داخل الأنبوبة تحت تأثير عجلة تسارع. فإذا كان فرق الجهد كبيراً بما يكفى فإن هذه الشحنات المتحركة ستقوم بتأين ذرات أخرى عند التصادم معها.
تميل الذرات ــ شأنها في هذا جميع النظم الفيزيائية ــ إلى الهبوط إلى أدنى حالة من حالات الطاقة الممكنة. وتفقد الإلكترونات المستثارة في ذرات الهيدروجين طاقاتها تلقائياً وتهبط بذلك إلى حالات ذات طاقات أدنى. فقد يهبط إلكترون مستثار في الحالة n =3، مثلاً، إلى الحالة n = 2، وبذلك يفقد بصورة أو بأخرى، فرق الطاقة بين هاتين الحالتين، وهو 3.4- 1.5 = 1.9 eV ومن الممكن أن تفقد الذرة هذا المقدار من الطاقة من خلال تصادمات متبادلة مع الذرات الأخرى. ويتجلى معظم الطاقة التي تفقد بهذه الطريقة في النهاية في صورة طاقة حرارية. إلا أن هناك وسيلة أخرى، يمكن بها للذرة أن تتخلص من الطاقة الزائدة؛ إنها تستطيع أن تشع فوتوناً.
افترض أن ذرة هيدروجين تقوم بإشعاع فوتون عندما يسقط إلكتروناً من المستوى n = j إلى المستوى n =i. إن الفرق بين طاقتي هذين المستويين Ej - Ei لابد أن يكون مساوياً لطاقة الفوتون الذي تم إشعاعه ولكن طاقة الفوتون هي hc/λ، ولذا يكون لدينا:
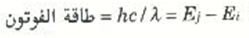
للتعويض بقيم كل من Ei وEj فإن:
(1) 
يلاحظ هنا أن المعادلة (1) تتخذ نفس الشكل الذي رأيناه في المعادلات التجريبية لسلاسل ليمان وبالمر وغيرها. أن ثابت ريدبرج R الذي تم تعيينه بالتجربة لابد أن يتساوى مع المعامل الموارد بالمعادلة (1) عند وضع Z = 1 (أي للهيدروجين):
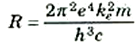
يضم هذا التعبير الرياضي على مالا يقل عن خمسة ثوابت فيزيائية أساسية ولعله يجدر بك أن تقوم بإجراء الحسابات المؤدية إلى إيجاد قيمة R = 1.0974×107 m-1 وقد كانت هذه النتيجة من الإنجازات المدهشة لنظرية بوهر التي كانت في تلك الأيام تستقر على أسس فيزيائية واهية.
وهكذا تقدم لنا المعادلة (1) تفسيراً لطيف الهيدروجين في إطار تغيرات طاقة الإلكترونات عندما يقفز بين الحالات المستقرة المتاحة. ويمكننا أن نكتب الصورة العامة للأطوال الموجية المسموح بها كالآتي:
(2) 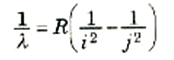
افترض ــ مثلاً ــ أن التصادم قد دفع بالإلكترون إلى المدار n =3، كما هو واضح في الشكل (3). إذا هبط الإلكترون مرتداً إلى المدار n =1، فإن أحد الفوتونات سينطلق حاملاً معه الطاقة المفقودة، وبالاستعانة بالمعادلة (2) نصل إلى:

التي يتضح أنها تعطى الخط الثاني في سلسلة ليمان. ويمكننا في الواقع، أن نحصل على سلسلة ليمان كلها إذا جعلنا i=1 و j = 2,3,4,…… في المعادلة (2)؛ تنبعث سلسلة ليمان من خطوط الطيف عندما يهبط الإلكترون من المدارات الخارجية إلى المدار n =1.
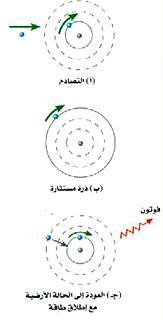
الشكل 3)): ذرة هيدروجين في الحالة الارضية n =1 عندما تستثار إلى الحالة n =3. إنها تبعث فوتوناً عندما تهبط إلى الحالة الأرضية مرة أخرى (لاحظ أن المدارات ليست مرسومة بمقياس رسم حقيقي)
وبالمثل، إذا هبطت الإلكترونات من المدارات الخارجية إلى الدار n =2، فإننا نحصل على سلسلة من الأطوال الموجية كالتالي:

وهي المعروفة بسلسلة بالمر. أي أن سلسلة بالمر من الخطوط الطيفية تنبعث عندما تهبط الإلكترونات إلى الدار n =2. وكما قد تتوقع فإن سلسلة باشن تنشأ من الانتقالات إلى المدار n =3. ويلخص الشكل 27-10 هذه الحقائق حيث ترى بعض الانتقالات الممكنة فقط.
يقل الفرق في الطاقة بين المستويات المختلفة بسرعة، كلما تناولنا مستويات أعلى فأعلى. وعلى ذلك، فإن الطاقة المنبعثة عندما يهبط الإلكترون من الدار 10 إلى الدار 2، لا تكاد تختلف عن الطاقة المنبعثة عندما يهبط من المدار 100 إلى المدار 2. ومعنى هذا أن الخطوط في سلسلة بالمر تصبح متقاربة جداً من بعضها البعض كلما أخذنا في تناول الاطوال الموجية المنبعثة نتيجة الانتقالات من المدارات الخارجية إلى المدار 2. ومن الطبيعي أن أكبر قدر من الطاقة سينبعث إذا هبط الإلكترون من خارج الذرة (n = ∞) إلى المدار n =2، وهذا يقودنا إلى انبعاث الطول الموجي لحد السلسلة.
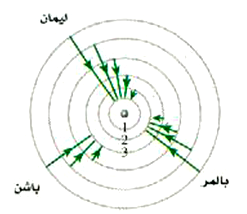
الشكل 4)): أصل السلاسل الطبقية المختلفة للهيدروجين (المدارات ليست مرسومة بمقياس رسم حقيقي).
ولمزيد من الإيضاح حول أصل هذه السلاسل الطبقية والذي سنعيد رسمه في الشكل 5))، مع إضافة خطوط رأسية ذات أسهم تبين الانتقالات الإلكترونية الممكنة. وهناك طريقة تجعلنا ندرك من لمحة واحدة كيفية تغير الأطوال الموجية للخطوط المنبعثة. إن طاقة الانتقال تتناسب مع طول الخط الرأسي ذي السهم المناظر لذلك الانتقال. ومن ثم تكون أسهم سلسلة ليمان (وليست كل الخطوط مبينة هنا) أطول من تلك المناظرة لسلسة بالمر، مما يدل ــ على الفور ــ على أن الأطوال الموجية لسلسة ليمان أقصر. وتستطيع أن ندرك بسهولة أيضاً من هذا الرسم البياني أن خطوط الطيف في سلسلة تناظر الانتقالات من قيم أعلى للعد n، سوف تكون متلاصقة جداً مع بعضها البعض، وذلك لأن لمستويات الطاقة هذه قيم تكاد تكون متساوية.
تمرين: احسب قيمة R إذا علمت قيم كل من m ، ....، h ، c ، e. استخدم القيم إلى أربعة أرقام معنوية.

الشكل 5)): رسم بياني لمستويات الطاقة المناظرة لمختلف السلاسل الطيفية للهيدروجين.
 الاكثر قراءة في مواضيع عامة في علم البصريات
الاكثر قراءة في مواضيع عامة في علم البصريات
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة

الآخبار الصحية















 قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة
قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة "المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة
"المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة (نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)
(نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)


















