

علم الكيمياء

تاريخ الكيمياء والعلماء المشاهير

التحاضير والتجارب الكيميائية

المخاطر والوقاية في الكيمياء

اخرى

مقالات متنوعة في علم الكيمياء

كيمياء عامة


الكيمياء التحليلية

مواضيع عامة في الكيمياء التحليلية

التحليل النوعي والكمي

التحليل الآلي (الطيفي)

طرق الفصل والتنقية


الكيمياء الحياتية

مواضيع عامة في الكيمياء الحياتية

الكاربوهيدرات

الاحماض الامينية والبروتينات

الانزيمات

الدهون

الاحماض النووية

الفيتامينات والمرافقات الانزيمية

الهرمونات


الكيمياء العضوية

مواضيع عامة في الكيمياء العضوية

الهايدروكاربونات

المركبات الوسطية وميكانيكيات التفاعلات العضوية

التشخيص العضوي

تجارب وتفاعلات في الكيمياء العضوية


الكيمياء الفيزيائية

مواضيع عامة في الكيمياء الفيزيائية

الكيمياء الحرارية

حركية التفاعلات الكيميائية

الكيمياء الكهربائية


الكيمياء اللاعضوية

مواضيع عامة في الكيمياء اللاعضوية

الجدول الدوري وخواص العناصر

نظريات التآصر الكيميائي

كيمياء العناصر الانتقالية ومركباتها المعقدة


مواضيع اخرى في الكيمياء

كيمياء النانو

الكيمياء السريرية

الكيمياء الطبية والدوائية

كيمياء الاغذية والنواتج الطبيعية

الكيمياء الجنائية


الكيمياء الصناعية

البترو كيمياويات

الكيمياء الخضراء

كيمياء البيئة

كيمياء البوليمرات

مواضيع عامة في الكيمياء الصناعية

الكيمياء الاشعاعية والنووية
بعض خصائص المواقع النشطة في الانزيمات
المؤلف:
أ.د.عيسى عبد السعداوي
المصدر:
الكيمياء الحيوية النظري
الجزء والصفحة:
ص 198
19-4-2016
15455
بعض خصائص المواقع النشطة في الانزيمات :
يعبر عن الموقع النشط للأنزيم بالمنطقة او المكان الذي ترتبط به المواد الأساسية، تمهيداً لظهور او تحطم الاواصر، وعلى الرغم من الاختلاف البنائي الكبير بين الانزيمات فإنه يمكن تعميم بعض الظواهر الخاصة بالمواقع النشطة والتي يمكن تحديد بعضها بما يلي :
- يشغل الموقع النشط في الانزيم حيزاً صغيراً من الجسم الكلي الكبير للأنزيم، وبذلك فإن معظم الأحماض الامينية في الانزيم ستكون بعيدة عن المادة الاساس، ويمكننا القول وبشكل عام ان معظم الانزيمات تتألف مما لا يقل عن مائة حامض أميني، لتعطي وزناً جزيئياً يزيد في معظم الأحيان عن العشرة آلاف.
- يتميز الموقع النشط كونه ثلاثي الأبعاد، فهو ليس بالنقطة ولا بالخط المستقيم ولا حتى بالمستوى ويترتب الشكل الثلاثي الابعاد من مجاميع مختلفة من مناطق متفرقة من السلسلة الببتيدية، اي ان لبعض الاجزاء البعيدة عن الموقع النشط قابلية ارتباط اقوى من المجاميع المجاورة للموقع النشط. وقد وجد فعلا ان بعض المجاميع المهمة في أنزيم متخصص لا تجاور بعضها البعض وانما توجد في مواقع متباعدة (101 ,63 ,62 ,52 ,35) من سلسلة تعاقبية مؤلفة من (129) حامضا امينياً.
- تعتمد خصوصية الارتباط بين المادة الاساس والموقع الفعال على ترتيب الذرات او المجاميع المعرفة بدقة في الموقع الفعال، فالمادة الاساس عليها ان تمتلك شكلا هندسيا مناسباً يتلائم وطبيعة وشكل الموقع الفعال، وبهذا الخصوص فقد اقترح أميل فيشر (Emil Fisher) في عام 1890م، نظرية القفل والمفتاح والموضحة في الاشكال التالية :
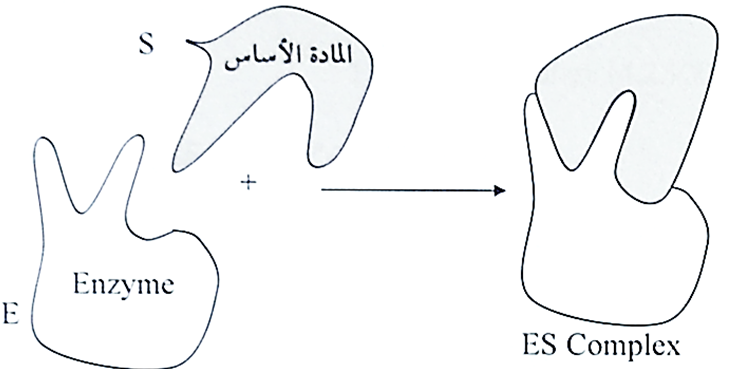

وعلى الرغم من نجاح هذه النظرية في تفسير طبيعة الارتباط بين الانزيم والمادة الاساس، فقد اظهرت الدراسات الحديثة ان المواقع النشطة لبعض الانزيمات ليست ثابتة الشكل، وإنما يبدأ بالتشكل عند اقتراب المادة الأساس من الأنزيم بعد ان تحدث بعض التغيرات في شكل الموقع الفعال بحيث يكون ملائماً للشكل الهندسي للمادة الأساس فيحدث الارتباط بينهما، ولقد سميت هذه التغيرات الديناميكية في شكل الموقع الفعال بنموذج الحث التوافقي (Indyced fit) وكما هو موضح في الشكل التالي :
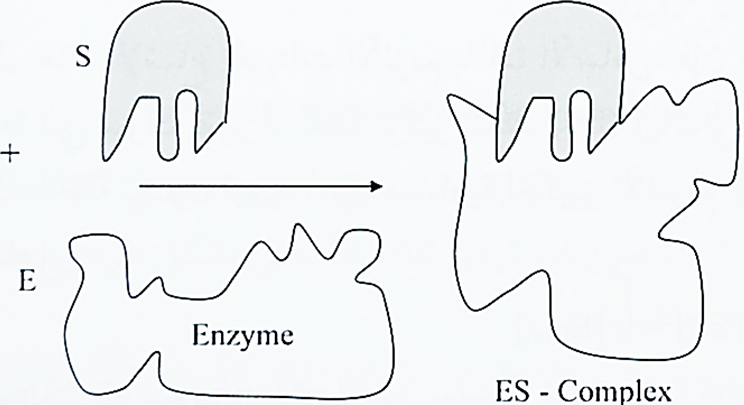

4. تكون الرابطة بين الانزيم والمادة الاساس ضعيفة نسبياً، فقد لوحظ ان ثوابت اتزان الحالة الوسطية (ES) تتراوح ما بين (2- 10 الى 8- 10) مول مقارنة مع طاقة التفاعل الحرة التي تتراوح ما بين (3-12) كيلو سعرة لكل مول، فعند المقارنة نجدها ليست بتلك القوة التي يحسب حسابها.
 الاكثر قراءة في الانزيمات
الاكثر قراءة في الانزيمات
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة

الآخبار الصحية















 قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة
قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة "المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة
"المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة (نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)
(نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)


















