
قوانين الغازات (قانون الغاز المثالي )
 المؤلف:
أ.د.محمد مجدي عبد الله واصل
المؤلف:
أ.د.محمد مجدي عبد الله واصل
 المصدر:
أسس الكيمياء الصناعية
المصدر:
أسس الكيمياء الصناعية
 الجزء والصفحة:
ص36-39
الجزء والصفحة:
ص36-39
 2025-01-26
2025-01-26
 1588
1588
عند تطبيق مبادئ حسابات نسب اتحاد المواد للغازات، فالعلاقة بين كتلة المادة ودرجة الحرارة والضغط والحجم مهمة جداً وهناك طرق عديدة متوفرة تبين تأثير تبدل واحد أو أكثر من هذه المتغيرات والقوانين التي تطبق على ما يسمى الغازات المثالية Ideal Gases مهمة جداً، ولو أنها ليست دقيقة ولكنها تعطى نتائج وافية بالغرض للحسابات الاعتيادية طالما تكون الغازات المعنية تحت ضغط لا يزيد عن ضغط جوي واحد أو اثنين .
قانون الغاز المثالي :
أدت البحوث التجريبية لعدد كبير من الغازات المختلفة وفي ظروف متغيرة الى المعادلة التالية ، المشتقة عملياً ، والتي تسمى معادلة الغاز المثالي PV = nRT
حيث P = الضغط المطلق كجم / (م) (ثانية) أو نيوتن/م2 أو باسكال.
V = حجم مولاتn من الغاز
n = عدد المولات من الغاز
T = درجة الحرارة المطلقة ك
R= ثابت الغاز العام .
=R 8.314 (كجم) (م2)/ (ثانية)2 (مول) (ك) .
8.314=R (نيوتن) (م) (مول) (ك) .
والتعبير عنه بالوحدات الثانوية أكثر شيوعاً ، حيث يستعاض عن
نيوتن متر بجول:
8.314=Rجول (مول) (ك)
و مقياس درجة الحرارة المطلقة يعتمد على نقطة الصفر المطلقة ، تلك الدرجة التي تتوقف عندها نظرياً حركة الجزئيات . ولقد وجد ان هذه الدرجة تساوی - 273م ودرجة الحرارة المطلقة بدرجات كلفن = درجة الحرارة بالمقياس المثوى + 273
مثال : تطبيق قانون الغاز المثالي
احسب الحجم الذى تشغله مولان من الغاز المثالي تحت ضغط 120 كيلو باسكال Kpa وعند درجة حرارة 300ك .
الحل :

مثال 4 : تطبيق قانون الغاز المثالي : إذا كانت درجة حرارة غاز 311 ك وضغطه 96.5 كيلو باسكال ويشغل حجما مقداره 1.416م ، فما حجمه اذا تغيرت درجة الحرارة الى 339 ك والضغط الى 172.4 كيلو باسكال ؟
الحل :
يمكن التعبير عن الظروف الأولى حسب قانون الغاز المثالي : (96.5) (1.416) = (n) (R) (311) دع V2 يمثل الحجم في الظروف الثانية والتى يمكن التعبير عنها :(172.4) (V2)=(n) (R) (339) وحيث لم يضف أو يؤخذ غاز من الجهاز فعدد مولات الغاز يجب ان تكون متساوية في المعادلتين (1) و (2) كما أن قيمة R ثابتة لكل المعادلتين وذلك لاستعمال نفس الوحدات للكميات المماثلة وبتقسيم المعادلة (2) على المعادلة (1) يحذف n و R وينتج حجم الغاز في الظروف الثانية
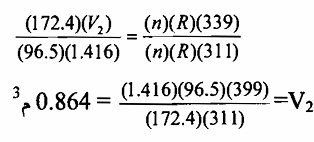
 الاكثر قراءة في مواضيع عامة في الكيمياء الصناعية
الاكثر قراءة في مواضيع عامة في الكيمياء الصناعية
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة


