
القوانين الكيميائية والأوزان المكافئة
 المؤلف:
أ.د.محمد مجدي عبد الله واصل
المؤلف:
أ.د.محمد مجدي عبد الله واصل
 المصدر:
أسس الكيمياء الصناعية
المصدر:
أسس الكيمياء الصناعية
 الجزء والصفحة:
ص35-36
الجزء والصفحة:
ص35-36
 2025-01-26
2025-01-26
 500
500
يمكن إيجاد العلاقة بين أوزان المواد المتفاعلة (Reactants) والمواد الناتجة (Products) فى تفاعل كيميائي من دراسة معادلة التفاعل والكتل المولية للمواد فتكتب المعادلة بحيث تكون المواد المتفاعلة في الجهة اليسرى والمواد الناتجة في الجهة اليمنى والكتل المولية لأي عنصر أو مركب يمكن الحصول عليها من جدول الأوزان الذرية ولتوضيح ذلك، يمكن أن يؤخذ انتاج ثاني أوكسيد الكبريت بأكسدة بيرات الحديد (Pyrites) كمثال فالمواد الأوكسجين والبيرات، المواد الناتجة هي ثاني أوكسيد الكبريت
المتفاعلة هي وأوكسيد الحديديك ويمكن كتابة المعادلة كما يلي: 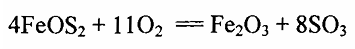
الصيغة الكيميائية للبيرات يمكن أن تؤخذ FeS2 ، والكتلة المولية لهذا المركب تساوى الوزن الذرى للحديد زائدا ضعف الوزن الذرى للكبريت أو تساوی 55.85 + (2) (32.06) = 119.97 ويمكن الحصول على الكتل المولية للمواد الأخرى المشمولة فى التفاعل بطريقة مماثلة . وحسب معادلة التفاعل 4 مولات من 2FeS تتفاعل مع 11 مول O2 لتنتج مولين Fe2O3 و 8 مولات 2SO . ويمكن كتابة ذلك بشكل يدل على الأوزان المشمولة بالاتحاد :
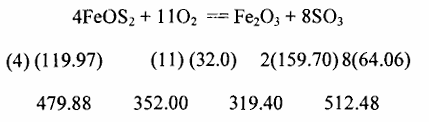
أى أن 479.88 أجزاء وزنية Fes تتفاعل مع 352.00 أجزاء وزنية أوكسجين لإنتاج 319.40 أجزاء وزنية Fe2O3 و 512.48 أجزاء وزنية. SO2هذه النسب الوزنية يجب ان تسرى على هذا التفاعل بغض النظر عن كمية كل المواد الموجودة فإذا كان وزن احد المركبات معروفا ، فمن الميسور حساب الكميات النظرية للمركبات الثلاثة الأخرى فكمية الأوكسجين الضرورية للتفاعل مع 100كجم من كبريتيد الحديد تساوى وزن الأوكسجين اللازم لكيلو جرام من كبريتيد الحديد مضروبا بمائة . أو : 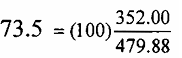
كجم من الاوكسجين اللازم للتفاعل مع 100 كجم من كبريتيد الحديد وبطريقة مماثلة ، وزن أوكسيد الحديديك الناتج من 100
كجم FeS2 يكون : 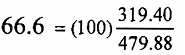 كجم ووزن ثاني اوكسيد الكبريت الناتج
كجم ووزن ثاني اوكسيد الكبريت الناتج 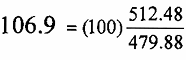 كجم ويمكن التأكد من هذه النتائج بتحديد امكانية اجراء الموازنة الكلية مجموع أوزان المواد المتفاعلة =100 + 73.5 = 173.5 كجم مجموع اوزان المواد الناتجة = 66.6+ 106.9 = 173.5 كجم وحيث ان وزن المواد الناتجة يساوى وزن المواد المتفاعلة فشرط الموازنة الكلية متوفر والنتائج لذلك صحيحة .
كجم ويمكن التأكد من هذه النتائج بتحديد امكانية اجراء الموازنة الكلية مجموع أوزان المواد المتفاعلة =100 + 73.5 = 173.5 كجم مجموع اوزان المواد الناتجة = 66.6+ 106.9 = 173.5 كجم وحيث ان وزن المواد الناتجة يساوى وزن المواد المتفاعلة فشرط الموازنة الكلية متوفر والنتائج لذلك صحيحة .
 الاكثر قراءة في مواضيع عامة في الكيمياء الصناعية
الاكثر قراءة في مواضيع عامة في الكيمياء الصناعية
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة


