

علم الكيمياء

تاريخ الكيمياء والعلماء المشاهير

التحاضير والتجارب الكيميائية

المخاطر والوقاية في الكيمياء

اخرى

مقالات متنوعة في علم الكيمياء

كيمياء عامة


الكيمياء التحليلية

مواضيع عامة في الكيمياء التحليلية

التحليل النوعي والكمي

التحليل الآلي (الطيفي)

طرق الفصل والتنقية


الكيمياء الحياتية

مواضيع عامة في الكيمياء الحياتية

الكاربوهيدرات

الاحماض الامينية والبروتينات

الانزيمات

الدهون

الاحماض النووية

الفيتامينات والمرافقات الانزيمية

الهرمونات


الكيمياء العضوية

مواضيع عامة في الكيمياء العضوية

الهايدروكاربونات

المركبات الوسطية وميكانيكيات التفاعلات العضوية

التشخيص العضوي

تجارب وتفاعلات في الكيمياء العضوية


الكيمياء الفيزيائية

مواضيع عامة في الكيمياء الفيزيائية

الكيمياء الحرارية

حركية التفاعلات الكيميائية

الكيمياء الكهربائية


الكيمياء اللاعضوية

مواضيع عامة في الكيمياء اللاعضوية

الجدول الدوري وخواص العناصر

نظريات التآصر الكيميائي

كيمياء العناصر الانتقالية ومركباتها المعقدة


مواضيع اخرى في الكيمياء

كيمياء النانو

الكيمياء السريرية

الكيمياء الطبية والدوائية

كيمياء الاغذية والنواتج الطبيعية

الكيمياء الجنائية


الكيمياء الصناعية

البترو كيمياويات

الكيمياء الخضراء

كيمياء البيئة

كيمياء البوليمرات

مواضيع عامة في الكيمياء الصناعية

الكيمياء الاشعاعية والنووية
التفاعل SN1 دور المذيب : الروابط (ايون – ثنائي قطب)
المؤلف:
Robert T. Morrison & Robert. N Boy
المصدر:
الكيمياء العضوية Organic chemistry
الجزء والصفحة:
p 278 - 6th ed
5-3-2017
5293
التفاعل SN1 دور المذيب : الروابط (ايون – ثنائي قطب)
The SN1 reaction : role of the solvent . Ion – dipole bonds
فسرنا عند مناقشة كل من التفاعلين SN1 و SN2 الفروق في التفاعلية بين الركائز المختلفة على أساس الفروق في كمية الطاقة اللازمة. فرأينا ان إحدى الركائز تتفاعل تفاعلاً أسرع من الأخرى ومحزوناً ذلك بصورة رئيسية إلى طاقة التنشيط Eact. في التفاعل SN1 مثلاً، يكون الاختلاف في سرعة التفاعل بين الركائز الثالثية والثانوية متوافقاً مع الاختلاف في Eact بحدود 15 كيلو حريرة.
ولكننا لم نتناول في دراستنا مسألة اكثر اهمية وهي الحالة التي تتضمن كميات اكبر من الطاقة. كيف يمكننا تعليل حقيقة ان الاستبدال يحدث ام لا يحدث، حتى بالنسبة لمعظم الركائز الفعالة؟ تنكسر الرابطة بين الكربون والزمرة المغادرة، كما في الرابطة كربون – هالوجين في هاليد الالكيل مثلاً، بأي من الآليتين SN1 أو SN2، ويتطلب كسر الرابطة طاقة . من اين تأتي هذه الطاقة؟
يكون الجواب واضحاً في حالة التفاعل SN2: إذ ان معظم الطاقة اللازمة لكسر الرابطة مع الزمرة المغادرة تتوافر من تشكيل الرابطة مع النوكليوفيل عند الهجوم بوساطة OH- ، مثلاً، تنكسر الرابطة كربون – هالوجين ، بينما تتشكل في الوقت نفسه الرابطة كربون – اكسجين.
ولكن ماذا يمكننا ان نقول بالنسبة لتفاعل SN1؟ تكون الخطوة المعينة لسرعة التفاعل هنا تحللاً لا متجانساً "بسيطاً" لتحطيم الرابطة دون ان تتشكل رابطة لموازنتها . تبين طاقات تفارق الرابطة في الطور الغازي ان التحلل اللامتجانس لهاليد الالكيل يتطلب مقداراً عالياً من الطاقة يصل إلى 149 كيلو حريرة / مول في حالة بروميد ثالثي البوتيل، وتصل حتى اكثر من ذلك في حالة ركائز اخرى. ومع ذلك يحدث التحلل اللامتجانس في التفاعل SN1 بسهولة عند درجات معتدلة من الحرارة بطاقة تنشيط Eact تتراوح بين 20 و 30 كيلو حريرة / مول فقط، وهذا يترك فرقاً في الطاقة يصل إلى 130 كيلو حريرة أو اكثر يجب توفيرها. من اين تأتي هذه القيمة الكبيرة جداً للطاقة؟

الشكل 1.1 التآثرات (ايون – ثنائي قطب) : كربوكاتيون وانيون مذوبان
الجواب مرة اخرى هو من تشكل الرابطة والأمر ليس تشكيل رابطة واحدة كما في التفاعل SN2، ولكن تشكيل العديد من الروابط، وهي الروابط بين الايونات الناتجة والمذيب. لا تتولد الايونات على شكل دقائق عارية في الفراغ القريب من الطور الغازي، وبدلاً من ذلك فإنها تتولد على هيئة ايونات مذوبة ، تتجمع حول كل ايون مجموعة من جزيئات المذيب متجهة بنهاياتها السالبة نحو الكربوكاتيون وبنهاياتها الموجبة نحو الأنيون (الشكل 1.1). تكون كل جزيئات المذيب متجهة بناهيات السالبة نحو الكربوكاتيون وبنهاياتها الموجبة نحو الأنيون (الشكل 1.1) . تكون كل
رابطة من الروابط (ايون – ثنائي قطب) بمفردها ضعيفة نسبياً ، ولكنها توفر عندما تكون مجتمعة كمية كبيرة من الطاقة .
ولكن الايونات هي منتجات التحلل اللامتجانس . وبما اننا نهتم هنا بسرعة التحليل اللامتجانس ، فعلينا إلا ندرس منتجات بل الحالة الانتقالية ، ثم نقارن استقرارها مع استقرار مادة البدء المتفاعلة.
يملك المتفاعل عزم ثنائي قطب وبشكل روابط (ثنائي قطب – ثنائي قطب مع جزيئات المذيب. (وفي الحقيقة يجب ان يختار المذيب من اجل هذا الغرض، لأنه خلافاً لذلك لن تتذوب المادة المتفاعلة.) رأينا ان الحالة الانتقالية تملك رابطة كربون – هالوجين ممتطة تتطور عليها جيداً شحنة موجبة واخرى سالبة.

تملك هذه الرابطة عزم ثنائي قطب اكبر مما هو في المادة المتفاعلة ، وتشكل روابط (ثنائي قطب – ثنائي قطب) مع المذيب تكون اكثر قوة. وبذلك يثبت المذيب الحالة الانتقالية بشكل افضل من تثنيته للمادة المتفاعلة ، مخفضاً بذلك طاقة التنشيط Eact، ومسرعاً التفاعل (الشكل 1.2) . ومثلما يثبت المذيب القطبي الايونات المتشكلة في التحليل اللامتجانس، فإنه يثبت ايضاً الايونات الابتدائية في الحالة الانتقالية التي تؤدي إلى تشكلها . في التفاعل SN1 لا ينفصل جزيء الركيزة ببساطة، بل انه ينفصل بفعل جزيئات المذيب.
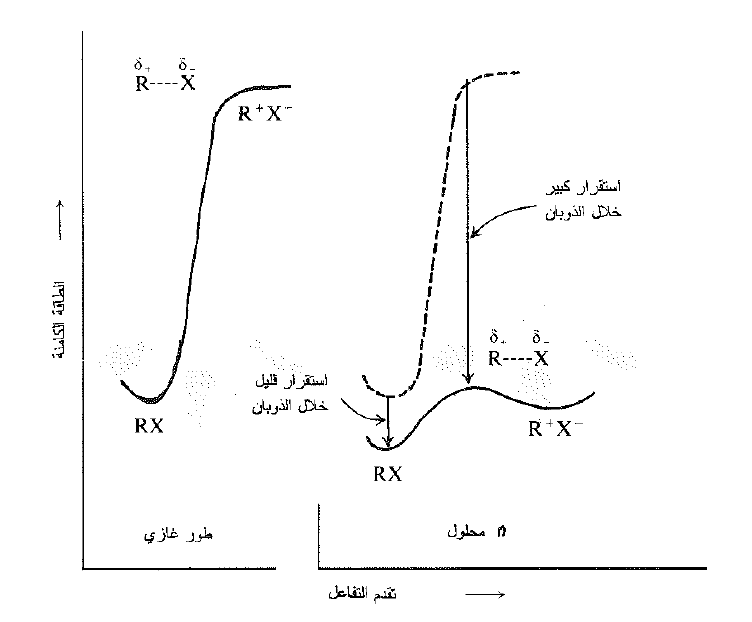
الشكل 1.2 : تأثير المذيب على سرعة التحلل اللامتجانس لهاليد الالكيل. تكون الحالة الانتقالية اكثر قطبية من المتفاعل ، وتكون اكثر بفعل الروابط (ثنائي قطب – ثنائي قطب).
ما ناقشناه حتى الآن هو اختلاف التحلل اللامتجانس بغياب المذيب او بحضوره. من الواضح ان تأثير المذيب يكون عظيماً، فهو يخفض طاقة التنشيط Eact بمقدار 130 كيلو حريرة أو أكثر ، وبذلك يسمح للتفاعل بالحدوث.
لندرس الآن الخطوة التالية في تحليلنا ولنتساءل أي نوع من المذيبات يسنح بفصم لا متجانس افضل؟ وبكلمات اخرى اي نوع من المذيبات يملك القوة المؤينة الاكبر؟ لنناقش من اجل السهولة تذوب المنتجات وهي الايونات بافتراض معقول، وهو ان العوامل التي تثبتها هي نفسها ايضاً العوامل التي تثبت الايونات الابتدائية في الخطوة الانتقالية.
وعلى هذا الاساس تتوقف القوة المؤينة للمذيب على تذويبها الجيد للأيونات . وبدورها تتوقف على قدرة المذيب على تذوب الايونات جزئياً على قطبيته . وعندما تكون الامور الاخرى متساوية فإنه كلما كان المذيب اكثر قطبية كلما كانت الروابط (ايون – ثنائي قطب) اقوى. وهكذا فإن التفاعلات SN1 التي تشارك فيها الركائز المعتدلة تحدث بسرعة اكبر في الملاء مما هي في الايثانول ، فهي تجري مثلاً في محلول 20% ايتانول (80:20، ايتانول : ماء) بصورة اسرع مما هي في محلول 80% ايتانول.
إن الأمر يتضمن أكثر بكثير من قطبية بسيطة. تتذوب الكاتيونات بصورة رئيسية عبر اشفاع من الالكترونات غير المشترك بها، اما الايونات فهي تتذوب بصورة رئيسية عبر الربط الهيدروجيني. وهنا تكون الكاتيونات كربوكاتيونات بسبب شحنتها المتشتتة، وهي تشكل روابط (ايون – ثنائي قطب) أضعف من أصغر الكاتيونات المعدني. ولذلك يكون تذوب الكاتيون عند تأين هذه الركائز العضوية ضعيفاً نسبياً مهماً كان المذيب.
بينما يكون تذوب الانيون هو الاكثر اهمية. ولهذه الغاية فإننا نرغب بمذيبات قادرة على الربط الهيدروجيني اي مذيبات بروتونية . وهكذا فإن التفاعلات SN1 تجري بسرعة اكبر في الماء والكحولات ومزائج من الماء والكحولات اكثر من سرعتها في المذيبات اللاقطبية مثل DMF و DMSO و HMPT.
يمكننا ان نذهب إلى أبعد من ذلك. تكون القوة المؤينة بين المذيبات البروتونية هي الأعلى في المذيبات التي تشكل الروابط الهيدروجينية الاقوى ، اي المذيبات ذات الهيدروجينات الأكثر حموضة . نذكر على سبيل المثال مركب 2، 2، -2 ثلاثي فلورو الايتانول (CF3CH2OH) الذي هو اكثر حموضة من الايتانول، ويعود سبب ذلك إلى السحب الالكتروني القوي الذي تمارسه ذرات الفلور، وبشكل هذا المركب روابط هيدروجينية اقوى من الزمر المغادرة ، وهو يعد مذيباً حيداص للتفاعلات SN1. وبالطريقة نفسها يعد حمض الفورميك (HCOOH) وحمض ثلاثي فلورو الاسيتيك (CF3COOH) مذيبين مؤينين جيدين.
شفع : زوج
اشفاع : ازواج
 الاكثر قراءة في مواضيع عامة في الكيمياء العضوية
الاكثر قراءة في مواضيع عامة في الكيمياء العضوية
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة

الآخبار الصحية















 قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة
قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة "المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة
"المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة (نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)
(نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)


















