

علم الكيمياء

تاريخ الكيمياء والعلماء المشاهير

التحاضير والتجارب الكيميائية

المخاطر والوقاية في الكيمياء

اخرى

مقالات متنوعة في علم الكيمياء

كيمياء عامة


الكيمياء التحليلية

مواضيع عامة في الكيمياء التحليلية

التحليل النوعي والكمي

التحليل الآلي (الطيفي)

طرق الفصل والتنقية


الكيمياء الحياتية

مواضيع عامة في الكيمياء الحياتية

الكاربوهيدرات

الاحماض الامينية والبروتينات

الانزيمات

الدهون

الاحماض النووية

الفيتامينات والمرافقات الانزيمية

الهرمونات


الكيمياء العضوية

مواضيع عامة في الكيمياء العضوية

الهايدروكاربونات

المركبات الوسطية وميكانيكيات التفاعلات العضوية

التشخيص العضوي

تجارب وتفاعلات في الكيمياء العضوية


الكيمياء الفيزيائية

مواضيع عامة في الكيمياء الفيزيائية

الكيمياء الحرارية

حركية التفاعلات الكيميائية

الكيمياء الكهربائية


الكيمياء اللاعضوية

مواضيع عامة في الكيمياء اللاعضوية

الجدول الدوري وخواص العناصر

نظريات التآصر الكيميائي

كيمياء العناصر الانتقالية ومركباتها المعقدة


مواضيع اخرى في الكيمياء

كيمياء النانو

الكيمياء السريرية

الكيمياء الطبية والدوائية

كيمياء الاغذية والنواتج الطبيعية

الكيمياء الجنائية


الكيمياء الصناعية

البترو كيمياويات

الكيمياء الخضراء

كيمياء البيئة

كيمياء البوليمرات

مواضيع عامة في الكيمياء الصناعية

الكيمياء الاشعاعية والنووية
تفاعل المرآة الفضية The Silver Mirror Redution:
المؤلف:
د.عمر محمود غباين
المصدر:
الكيمياء الاستعراضية
الجزء والصفحة:
p 173
5-2-2017
8410
تفاعل المرآة الفضية The Silver Mirror Redution:
عدة محاليل توضع في قارورة، وعند رج القارورة فان مرآة فضية تتكون لتكسو داخل القارورة.
الطريقة :
تحذير :
ان محلول الفضة الامونية يتكون كنتيجة في هذا العرض يمكنها ان تنفجر عند التوقف. اتبع طريقة التخلص المعروفة عند الانتهاء من العرض، امزج او اخلط المحاليل كما هو واضح في الطريقة، البس القفازات والنظارات الواقية واستخدم القناع الآمن :
- حضر للتعامل مع المواد الناتجة غير اللازمة بإضافة 5 مل من 4 معياري حمض HCL الى الكاس. وقم بعملية الترشيح.
- نظف القارورة سعة 50 مل.
- ضع 10 مل من محلول A في القارورة.
- امزج 5 مل من محلول B مع 5 مل من محلول C وأضف هذا الخليط الى القارورة انتبه : لا تقم بخلط هذه المحاليل قبل بدء العرض.
- بسرعة أضف 10 مل من محلول D الى القارورة.
- أغلق القارورة بسدادة فلين ومزجها بسرعة ولكن بحركة اهتزازية لطيفة، استمر في الهز الى ان تتكون المرآة.
- حالا صب المحلول الفضي من القارورة الى الكاس الذي يحوي الحمض كما في خطوة 1.
- حالا أيضا اغسل القارورة الفضية بداخلها عدة مرات بالماء وارم الناتج في الحوض (التصريف).
- رشح ما تبقى في الكاس وارم الناتج الى اسفل (في الحوض) وتعامل مع ما تبقى من مواد صلبة في الكاس بطريقة وفق تعليمات التخلص منها.
التفاعل :
يتكون عنصر الفضة عندما يقوم أيون الفضة بأكسدة جزء من جزيئات السكر (جلوكوز).
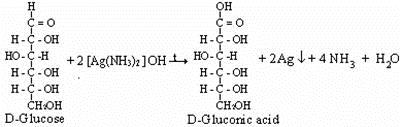
المحاليل :
- محلول A أذب 2.5 غم من الجلوكوز (ديكستروز) و 2.5 غم فركتوز في 50 مل من الماء اضف 0.6 غم من حمض طرطريك، اجعل المحلول يغلي وبعد ذلك برده اضف 10 مل من الكحول الايثيلي وخفف الى 100 مل.
- محلول B أذب 0.4 غم من نترات الفضة في 50 مل من الماء المقطر.
- محلول C أذب 6غم من نترات الأمونيوم في 50 مل من الماء.
- محلول D أذب 10 غم من هيدروكسيد الصوديوم في 100 مل من الماء، استخدم القناع.
أفكار تعليمية :
- يمكن استخدام قارورة كبيرة ذات قعر مدور ولكن عليك ان تهزها بسرعة لتغطية السطح بالمرآة الفضية.
- يريك هذا العرض اختزال الفضة الى معدن فضة وإمكانية اختزال السكر الذي يحوي مجموعة aldehyde.
- اذا لم تتكون المرآة فان القارورة يمكن ان لا تكون نظيفة.
- محلول الفضة الامونومية الناتج من هذا التفاعل هو متفجر كذلك يجب التخلص منه وبسرعة بالطرف السليمة.
- يمكنك إذابة المرأة المتكونة بحامض النيتريك المركز.
- الهيدروجين بمجموعة اللالهيد أمكن إزالته من جزيء السكر عندما تمت الأكسدة
 الاكثر قراءة في التحاضير والتجارب الكيميائية
الاكثر قراءة في التحاضير والتجارب الكيميائية
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة

الآخبار الصحية















 قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة
قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة "المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة
"المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة (نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)
(نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)


















