

علم الكيمياء

تاريخ الكيمياء والعلماء المشاهير

التحاضير والتجارب الكيميائية

المخاطر والوقاية في الكيمياء

اخرى

مقالات متنوعة في علم الكيمياء

كيمياء عامة


الكيمياء التحليلية

مواضيع عامة في الكيمياء التحليلية

التحليل النوعي والكمي

التحليل الآلي (الطيفي)

طرق الفصل والتنقية


الكيمياء الحياتية

مواضيع عامة في الكيمياء الحياتية

الكاربوهيدرات

الاحماض الامينية والبروتينات

الانزيمات

الدهون

الاحماض النووية

الفيتامينات والمرافقات الانزيمية

الهرمونات


الكيمياء العضوية

مواضيع عامة في الكيمياء العضوية

الهايدروكاربونات

المركبات الوسطية وميكانيكيات التفاعلات العضوية

التشخيص العضوي

تجارب وتفاعلات في الكيمياء العضوية


الكيمياء الفيزيائية

مواضيع عامة في الكيمياء الفيزيائية

الكيمياء الحرارية

حركية التفاعلات الكيميائية

الكيمياء الكهربائية


الكيمياء اللاعضوية

مواضيع عامة في الكيمياء اللاعضوية

الجدول الدوري وخواص العناصر

نظريات التآصر الكيميائي

كيمياء العناصر الانتقالية ومركباتها المعقدة


مواضيع اخرى في الكيمياء

كيمياء النانو

الكيمياء السريرية

الكيمياء الطبية والدوائية

كيمياء الاغذية والنواتج الطبيعية

الكيمياء الجنائية


الكيمياء الصناعية

البترو كيمياويات

الكيمياء الخضراء

كيمياء البيئة

كيمياء البوليمرات

مواضيع عامة في الكيمياء الصناعية

الكيمياء الاشعاعية والنووية
الحالة الانتقالية Transition state
المؤلف:
Robert T. Morrison & Robert. N Boy
المصدر:
الكيمياء العضوية Organic chemistry
الجزء والصفحة:
p 68 - 6th ed
8-11-2016
7484
الحالة الانتقالية Transition state
من الواضح أن مفهوم طاقة التنشيط (Eact) هو المفتاح لفهم التفاعلية الكيميائية. ولجعله ذا فائدة، نحتاج الى مفهوم آخر هو: الحالة الانتقالية.
يعد التفاعل الكيميائي، افتراضياً، عملية مستمرة تشمل انتقالاً تدريجياً من المتفاعلات الى المنتجات. وجد أنه من المفيد جداً، اعتبار ترتيب الذرات عند مرحلة متوسطة للتفاعل، كما لو كان هناك جزيء فعلي. تدعى هذه البنية المتوسطة (الحالة الانتقالية) ويوافق محتواها من الطاقة قمة هضبة الطاقة (الشكل 1.1).
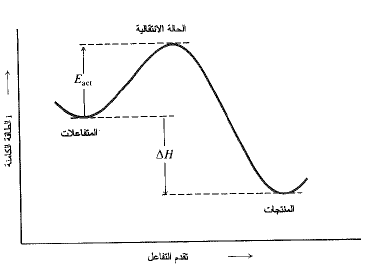
الشكل 1.1: تغيرات الطاقة الكامنة مع تقدم التفاعل: حالة انتقالية على قمة هضبة الطاقة
ويكون تتابع التفاعل كما يلي:

وكما أن (ΔH) هي الفرق فيا لطاقة بين المتفاعلات والمنتجات فإن (Eact) هي الفروق في الطاقة بين المتفاعلات والحالة الانتقالية. إن مفهوم الحالة الانتقالية مفيد للسبب التالي:
إننا نستطيع تحليل بنية الحالة الانتقالية كما لو كانت جزيئاً، كما يمكن أن نقدر استقرارها. وإن أي عامل يؤدي الى استقرار الحالة الانتقالية، بالنسبة الى المتفاعلات يميل الى تخفيض طاقة التنشيط، وهذا يعني أن أي عامل يخفضن قمة هضبة الطاقة أكثر مما يخفض وادي المتفاعلات، يقلل الارتفاع الصافي الذي علينا تسلقه خلال التفاعل.
إن استقرار الحالة الانتقالية هو تقريباً الأساس – سواء شئنا أم أبينا – لكل نقاش يدور حول التفاعلية .
إلا أن الحالة الانتقالية ليست إلا ترتيباً عائماً للذرات التي بطبيعتها تقع على قمة هضبة الطاقة ولا يمكن عزلها أو تفحصها. كيف يتسنى لنا معرفة أي شيء عن بنيتها؟ حسناً لنأخذ، على سبيل المثال، الحالة الانتقالية لنزع هيدروجين من الميثان من قبل ذرة هالوجين، ولنرى إلى أين سيقودنا القليل من التفكير.
في البدء يمكن بالتأكيد، القول: إن الرابطة كربون – هيدروجين قد استطالت ولكنها لم تنقطع تماماً، وأن الرابطة هيدروجين – هالوجين قد بدأت بالتشكل إلا أنها لم تكتمل.
يمكن تمثيل هذا الشرط كما يلي:
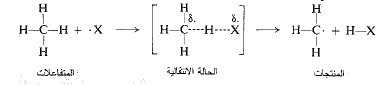
حيث تمثل الخطوط المتقطعة الروابط المحطمة أو المتشكلة جزئياً.
ماذا يمكن الآن القول عن شكل زمرة المثيل في هذه الحالة الانتقالية؟ في المتفاعلات، حيث المثيل ممسكاً الهيدروجين يكون الكربون رباعي وجوه (تهجين sp3)؛ وفي المنتجات، حيث يفقد المثيل الهيدروجين يكون الكربون ثلاثي الوجوه (تهجين sp2). وفي الحالة الانتقالية، حيث الرابطة كربون – هيدروجين مكسورة جزئياً، يكون تهجين الكربون، ما بين (sp3) و(sp2). وتكون زمرة المثيل، منبسطة جزئياً وليس كلياً؛ والزوايا بين الروابط أكبر (109.5˚) وأصغر من (120˚).
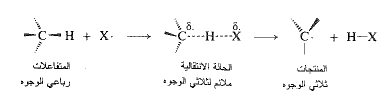
أخيراً، أين هو مكان الالكترون المفرد؟ إنه على الاكلور في المتفاعلات وعلى زمرة المثيل في المنتجات، وهو مزع بين الاثنين في الحالة الانتقالية. (مثلث حصة كل ذرة بالزمرة ...). تحمل زمرة المثيل، جزئياً، الالكترون المفرد الذي سيكون لها في المنتجات، وهي في ذلك تكون قد اكتسبت بعض خصائص الجذر الحر الذي ستكونه.
وهكذا، بطريقة مباشرة، نكون قد رسمنا صورة للحالة الانتقالية التي تظهر عملية الرابطة وعملية تشكل الرابطة والترتيب الفراغي للذرات، وتوزع الالكترونات.
(إن هذه الحالة الانتقالية الخاصة هي حالة متوسط بين المتفاعلات والمنتجات، وليس فقط بالنسبة لتتابع الزمن، بل وكذلك بالنسبة للبنية تكون المتفاعلات والمنتجات في تفاعل SN2 رباعية الوجوه، في حين تحتوي الحالة الانتقالية على كربون خماسي التكافؤ.
لقد نظرنا الى موضوع سرعة التفاعل من وجهة نظر نظرية التصادم وهناك اتجاه بديل، أكثر فائدة عامة، هو نظرية الحالة الانتقالية (أو الترموديناميك).
لقد افترض وجود توازن بين المتفاعلات والحالة الانتقالية، وعولج هذا التوازن بنفس الطريقة التي يعالج بها توازن التفاعلات العكوس . وضعنا مكان طاقة التنشيط (Eact) وعامل الاحتمال، بالترتيب، حرارة (التالبية) التنشيط (ΔH+) وأنتروبية التنشيط (ΔS+)، اللتين تؤلفان، معاً، طاقة التنشيط الحرة (ΔG+).
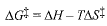
فكلما كانت ..... أصغر (أقل إيجاباً) وكلما كانت .... أكبر (أكثر ايجاباً)، تكون .... أصغر، ويكون التفاعل أسرع.
توافق الانتروبية، بشكل تقريبي عشوائية المنظومة ويميل التوازن الى تفضيل الجانب الذي تكون فيه القيود على الذرات والجزيئات أقل وتكون أنتروبية التنشيط عندئذ، هي قياس العشوائية النسبية للمتفاعلات والحالة الانتقالية، فكلما كانت القيود الموضوعة على ترتيب الذرات في الحالة الانتقالية – نسبة للمتفاعلات – أقل جرى التفاعل بسرعة أكبر. ويمكن أن نرى، بطريقة عامة، كيف يقيس عامل الاحتمال وانتروبية التنشيط الشيء ذاته.
يدل عامل الاحتمال المنخفض على لزوم نوع من التوجه المناسب للذرات عند التصادم. وبتعبير آخر، تدل أنتروبية التنشيط المنخفضة غير المواتية أن هناك قيوداً صارمة قد وضعت على الذرات في الحالة الانتقالية.
 الاكثر قراءة في الهايدروكاربونات
الاكثر قراءة في الهايدروكاربونات
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة

الآخبار الصحية















 قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة
قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة "المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة
"المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة (نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)
(نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)


















