

علم الكيمياء

تاريخ الكيمياء والعلماء المشاهير

التحاضير والتجارب الكيميائية

المخاطر والوقاية في الكيمياء

اخرى

مقالات متنوعة في علم الكيمياء

كيمياء عامة


الكيمياء التحليلية

مواضيع عامة في الكيمياء التحليلية

التحليل النوعي والكمي

التحليل الآلي (الطيفي)

طرق الفصل والتنقية


الكيمياء الحياتية

مواضيع عامة في الكيمياء الحياتية

الكاربوهيدرات

الاحماض الامينية والبروتينات

الانزيمات

الدهون

الاحماض النووية

الفيتامينات والمرافقات الانزيمية

الهرمونات


الكيمياء العضوية

مواضيع عامة في الكيمياء العضوية

الهايدروكاربونات

المركبات الوسطية وميكانيكيات التفاعلات العضوية

التشخيص العضوي

تجارب وتفاعلات في الكيمياء العضوية


الكيمياء الفيزيائية

مواضيع عامة في الكيمياء الفيزيائية

الكيمياء الحرارية

حركية التفاعلات الكيميائية

الكيمياء الكهربائية


الكيمياء اللاعضوية

مواضيع عامة في الكيمياء اللاعضوية

الجدول الدوري وخواص العناصر

نظريات التآصر الكيميائي

كيمياء العناصر الانتقالية ومركباتها المعقدة


مواضيع اخرى في الكيمياء

كيمياء النانو

الكيمياء السريرية

الكيمياء الطبية والدوائية

كيمياء الاغذية والنواتج الطبيعية

الكيمياء الجنائية


الكيمياء الصناعية

البترو كيمياويات

الكيمياء الخضراء

كيمياء البيئة

كيمياء البوليمرات

مواضيع عامة في الكيمياء الصناعية

الكيمياء الاشعاعية والنووية
المدارات الهجينة sp3 Hybrid orbitals : sp3
المؤلف:
Robert T. Morrison & Robert. N Boy
المصدر:
الكيمياء العضوية Organic chemistry
الجزء والصفحة:
p 15 - 6th ed
31-10-2016
6960
المدارات الهجينة: sp3 Hybrid orbitals sp3
نلتفت الآن الى أبسط الجزيئات العضوية على الأطلاق، الميتان CH4.
يملك الكربون الكتروناً غير متزاوج في اثنين من المدارات p، وعلى هذا يمكن أن نتوقع أنه سيشكل المركب CH2. (إنه يقوم بذلك فعلاً إلا أن CH2 جزيء على التفالعية، تتمركز صفاته حول الحاجة الى توفير كربون ذي رابطتين إضافيتين). ومرة أخرى نرى الميل الى تشكيل أكبر عدد ممكن من الروابط وفي هذه الحالة الى الاتحاد مع أربع ذرات هيدروجين.
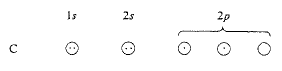
ولتوفير أربعة الكترونات غير متزاوجة، نرفع أحد الالكترونين 2s الى المدار p الشاغر.
رفع الكترون واحد: أصبح لدينا أربعة الكترونات غير متزاوجة
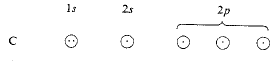
ونجد مرة أخرى إن المدارات الأشد توجيهاً هي مدارات هجينة: هذه المرة هي المدارات sp3، الناتجة عن مزج
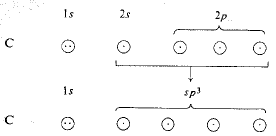
مدار واحد s مع ثلاثة مدارات p. يملك كل منها الهيئة المبينة في الشكل 1.1؛ وكما هو الحال في المدارات sp و sp2، فإننا سنهمل الانتفاخ الخلفي الصغير ونمثل الانتفاخ الأمامي بكرة.
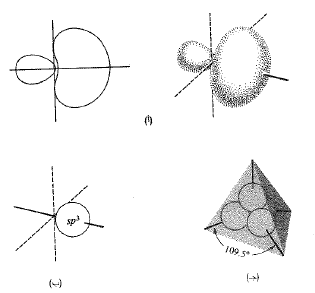
الشكل 1.1: المدارات الذرية: المدارات الهجينة sp3 (أ) مقطع عرضي والهيئة التقريبية لمدار مفرد. إنه موجه بقوة وفق أحد المحاور. (ب) تمثيل بشكل كرة، انتفاخ خلفي صغير مهمل. (جـ) أربعة مدارات، محاورها موجهة نحو رؤوس رباعي وجوه.
لنر الآن كيف تترتب المدارات sp3 في الفراغ. ولن يكون الجواب التالي مستغرباً: يجب أن تترتب هذه المدارات في الفراغ بحيث تبتعد بعضها عن بعض بأكبر قدر ممكن. إنها تتوجه نحو زوايا رباعي وجود منتظم. وتكون الزاوية بين أي مدارين هي زاوية رباعي الوجود المساوية 109.5˚ (الشكل 1.1). وكما يؤدي التدافع بين المدارات الى اعطاء رابطتين خطيتين أو ثلاث روابط مثلثة فإنه يؤدي هنا الى أربع روابط رباعية.
ينتج الميتان عن تراكب كل مدار من المدارات sp3 التابعة لذرة الكربون، مع مدار s لذرة هيدروجين: ويكون الكربون واقعاً في مركز رباعي وجوه منتظم، في حين تقع ذرات الهيدروجين الأربعة في رؤوسه (شكل 2.1).
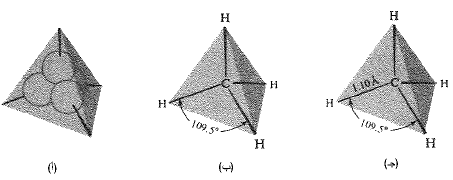
الشكل 2.1: تشكل رابطة جزيء CH4 (أ) مداراتsp3 رباعية الزاوية. (ب) الهيئة المتوقعة. تقع نوى H في تراكب أعظمي. (جـ) الهيئة والحجم
لقد وجد تجريبياً أن الميتان أعلى بنية رباعية الوجود متناظرة معروفة يكون لكل رابطة كربون – هيدروجين فيه نفس الطول A1.10، وتكون الزاوية بين أي رابطتين فيه هي زاوية رباعي الوجود المساوية 109.5˚. وتحتاج لتحطيم رابطة واحدة في جزيء الميتان مقدار 104 كيلو حريرة/مول من الطاقة.
لقد رأينا في دراسة الفقرات الثلاث الأخيرة، أن هذه الدراسة لم تقتصر على الرابطة المشتركة من حيث صفاتها وطولها وطاقة تفارقها، بل شملت أيضاً معلومات عن زاوية الترابط. يمكن بسهولة توضيح علاقة زوايا الترابط هذه بترتيب المدارات الذرية – بما في ذلك المدارات الهجينة – المتصمنة تشكيل الروابط، وتعود هذه الروابط في النهاية الى مبدأ الاستبعاد لباولي وإلى ميلا لالكترونات غير المتزاوجة الى الابتعاد بعضها عن بعض بأكبر قدر ممكن.
وتختلف الرابطة المشتركة عن الرابطة الأيونية، التي تساوي في القوة في كافة الاتجاهات، لأن الرابطة المشتركة هي رابطة موجهة. وربما نستطيع أن نبدأ من هنا في فهم سبب الاهتمام الكبير الذي توليه كيمياء الروابط المشتركة لأشكال وحجوم الجزيئات.
ولما كانت مركبات الكربون ترتبط ذراتها غالباً بروابط مشتركة، لذا فإن الكيمياء العضوية معنية كثيراً أيضاً بأشكال وحجوم الجزيئات. ولتسهيل دراستنا، سنستعين بصورة متكررة بالنماذج الجزيئية. يوضح الشكل (3.1) كيفية تمثيل جزيء الميتان بالاستعانة بثلاث تقانات مختلفة هي: الكرات والعصي Stick-and-ball، والهيكلة Framework، ومالئات الفراغات Space-filing. يصنع النموذج الأخير حسب المقاس ويظهر ليس فقط زوايا الترابط، بل وكذلك أيضاً أطول الروابط وحجوم الذرات.

الشكل 3.1: نموذج لجزيء الميتان. (أ) كرات وعصي (Allyn & Bacon) (ب) هيكل (Prentic Hall). (جـ) مالئ فراغ (CPK)؛ كل 1.25 سم لكافئ (A1.00).
 الاكثر قراءة في مواضيع عامة في الكيمياء العضوية
الاكثر قراءة في مواضيع عامة في الكيمياء العضوية
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة

الآخبار الصحية















 قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة
قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة "المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة
"المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة (نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)
(نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)


















