اسمدة النتروجين Nitrogen Fertilizers
في البداية لابد من التطرق الى بعض من تحولات النتروجين في التربة وبعض المفاهيم ذات العلاقة.
تحولات النتروجين في التربة:
النتروجين في التربة يتواجد بصورة رئيسة على شكل نتروجين عضوي (95-90 %) والمتبقي يكون بشكل غير عضوي (معدني). النبات لا يستفيد من النتروجين العضوي الى بعد تحوله الى المعدني بعملية تسمى المعدنة. جزء بسيط من النتروجين العضوي تتم معدنته سنوياَ وبنسبة 1-5 % من النتروجين العضوي الموجود.
معدنة النتروجين Mineralization
تحول النتروجين من الشكل العضوي الى الاشكال المعدنية او بتعبير اخر الى الاشكال الجاهزة للامتصاص من النبات وتشمل على عدد من الخطوات كما يأتي:
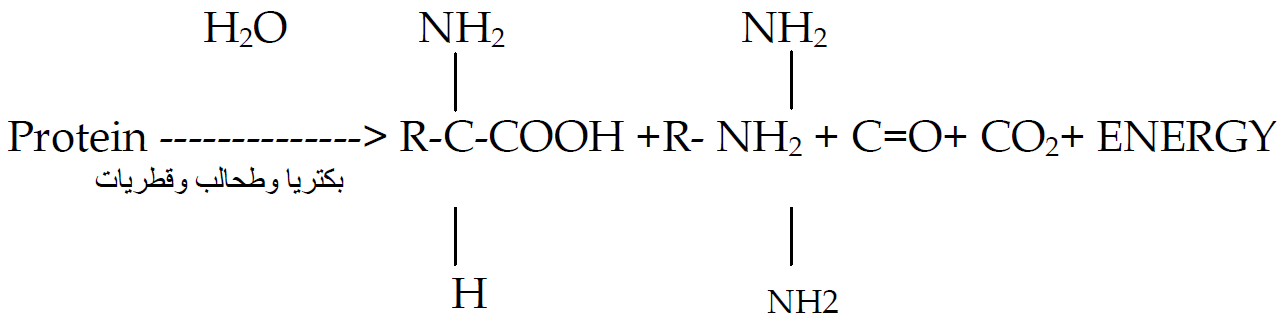
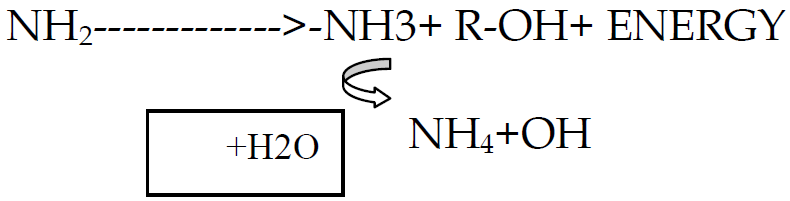
وتشترك في هذه العمليات عدد كبير من الأحياء المجهرية المتواجدة في التربة والتي تتطلب ظروف جيدة ومغذيات للقيام بعملها.
الامونيوم الناتج من هذه العملية يتعرض الى:
ممكن ان يتحول الى النتريت NO2-1 والنترات NO3-1 بعملية تسمى النترجة Nitrification
يمتص بشكل مباشر من النبات Uptake
يثبت في أجسام الأحياء المتعددة التغذية بعملية تسمى التثبيت Immobilization
يثبت داخل طبقات معادن الطين بعملية تسمى تثبيت الامونيوم Fixation
يمتز على سطوع الغرويات
يتحول الامونيوم إلى آمونيا بعملية تسمى التطاير Volatilization
تحولات النتروجين في التربة تتأثر بالمحتوى الرطوبي والحرارة للتربة وعوامل اخرى لأنها عمليات كيموحيوية تتم بوساطة الأحياء المجهرية.
النترجة Nitrification
اكسدة الامونيوم الى النتريت والنترات وكما يأتي:

______________________________________________
2NH4 + 4O2 ---------------------> 2NO3- + 2H2O + 4H+
النتروزوموناس والنتروباكتر بكتريا ذاتية التغذية تحصل على طاقتها من اكسدة النتروجين وتحصل على الكاربون من ثنائي اوكسيد الكاربون. وهي بكتريا هوائية اجاريا، لذا تتطلب العملية توافر مستوى جيد من الاوكسجين.
وباختصار فان عملية المعدنة عبارة عن عمليتي النشدرة والنترجة

غسل النترات Leaching:
النترات ذائبة بالماء ولا تمسك من قبل مكونات التربة وهي عالية الحركة في التربة ولذا فهي عرضة للفقد بالغسل تحت المناخات الرطبة وغزارة هطول الأمطار والزراعة المروية لاسيما عندما تكون ظروف التربة الفيزيائية تسمح بذلك. هذا الفقد مهم من الناحية الاقتصادية والبيئية ويجب السيطرة عليه قدر الإمكان. وللتقليل من هذا الفقد يمكن:
استخدام أسمدة نتروجينيه بطيئة التحرر مثل اليوريا المغلفة بالكبريت
او استخدام مثبطات النترجة (النيتروبايرين (البيرميدين) او ما يسمى تجارياَ (حامي او حافظ النتروجين N-Serve)
اوالإضافات المتكررة للنتروجين (تجزئة الإضافة الى دفعات) هو ما يسمى بإضافة السماد بشكل يتناسب مع المتطلبات.
فقد النتروجين بشكل غازات:
التطاير Volatilization:
عملية تحول الامونبوم الى امونيا من خلال الاتي:
+ NH4 <======= >NH3 + H
العامل الرئيس المؤثر هنا هو درجة تفاعل التربة ال pH والعملية تحدث في الترب القاعدية والترب الكلسية (او بشكل عام عندما يكون pH التربة اعلى من 7.5 ومن العوامل الاخرى المؤثرة درجة الحرارة والحراثة والغطاء الخضري والرطوبة.
ومن اهم العمليات للتقليل من هذا الفقد هو الاضافة الموضعية للسماد النتروجيني أي التلقيم والري بعد الاضافة مباشرةَ ومحاولة استعمال الاسمدة المولدة للحموضة قدر الامكان واستعمال مثبطات اليوريز. ومن الامثلة على التطاير:
(NH4)2SO4+CaCO3---------> 2NH3↑ + CO2+H2O+CaSO4
((NH4)2CO3 + H2O ---------> NH3↑ + CO2 + H2O
عكس النترجة Denitrification:
عملية اختزال النترات او تحول النترات من الشكل الذائب بالماء الى غازات النتروجين تحت ظروف لاهوائية وبمساعدة بكتريا لاهوائية اجبارية هي Denitrifying bacteria ومنها Pseudomonas
NO3- --------> NO2- --------> NO ---------> N2O ---------> N2
وهذه العملية مهمة من الناحية البيئية والاقتصادية لأن النتروجين المفقود بشكل غازات يؤثر في طبقة الاوزون (O3).
تثبيت النتروجين الجوي Nitrogen Fixation:
النتروجين الجوي لا تستفيد منه النباتات إلا اما من خلال التثبيت من خلال البرق (كسر الاصرة الثلاثية) او التثبيت من قبل الأحياء المجهرية. والتثبيت من قبل الأحياء المجهرية يتم اما بشكل تعايشي او حر.
التثبيت ألتعايشي للنتروجين الجوي: symbiotic N fixation:
وهذا التثبيت يحدث نتيجة عملية تعاونية بين الاحياء المجهرية والمحاصيل البقولية. وتتم العملية بعد مهاجمة نوع من البكتريا تسمى اريزوبيا لجذور البقوليات وتكوين ما يسمى بالعقدة الجذرية وهذه البكتريا تحول النتروجين الجوي الى امونيوم في داخل العقدة الجذرية وهنا يحدث عملية تعايش او تبادل منفعة بين البقول والبكتريا. وهناك بكتريا متخصصة لكل محصول بقولي. البكتريا تقوم بالتثبيت باستعمال انزيم النتروجنيز و ال ATP وهذه الطاقة مهمة لعملية التثبيت. ومن العوامل المهمة والمؤثرة في عملية التثبيت ال pH ومستوى العناصر المغذية وهنا المغنيسيوم والفسفور والمولبديوم والكوبالت والحديد والبورون والنحاس مهمة للعملية، مع ان كافة العناصر المغذية مهمة بدون استثناء.
وعملية التثبيت هذه تجعل من محاصيل البقول مهمة جداَ ويجب ان تتضمن في الدورات الزراعية للمحافظة على خصوبة التربة وتقليل التلوث البيئي الناجم عن اضافة الاسمدة المعدنية. وهذا من المواضيع المهمة التي تؤكد عليه منظمة الغذاء والزراعة الدولية FAO.
هذا مع العلم ان معظم انواع الرايزوبيا متوافرة في الترب والبيئة العراقية وفي حالة عدم توافرها يجب استعمال اللقاح المناسب الذي يجب ان يضاف كل ثلاث سنوات كما هو الحال مع بكتريا الرايزوبيا المتخصصة على فول الصويا (عبد الرضا ، 1997 و العارضي ، 1997 و فتاح ، 1997 و ابو الكلل ، 2000)
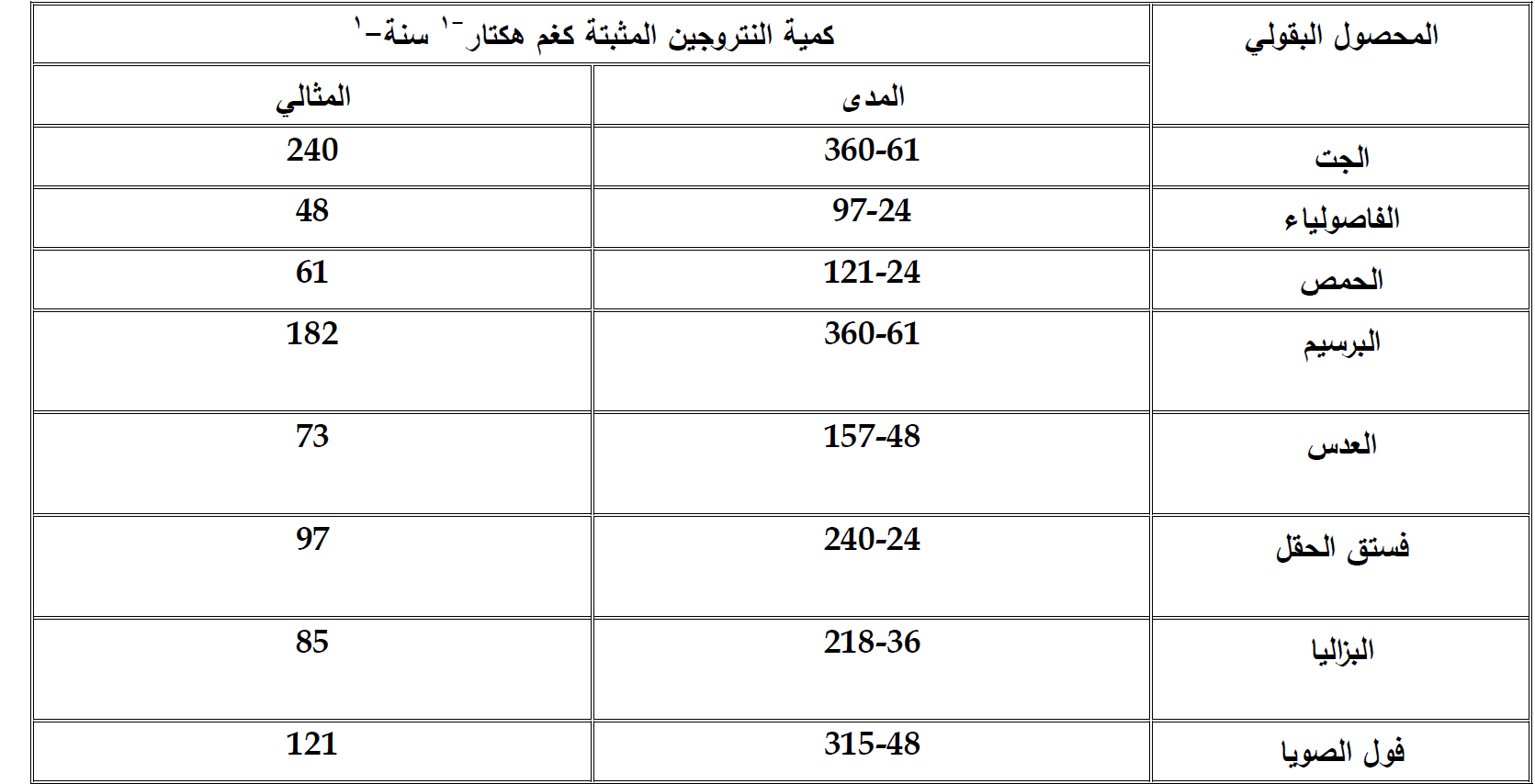
والجدول 1 يبين الكميات من النتروجين التي من الممكن ان تثبت من قبل هذه الاحياء وهذه الكميات تختلف حسب المناخات المختلفة وهنا للمناطق المعتدلة:
جدول 1 كميات النتروجين التي من الممكن ان تثبت من قبل هذه الاحياء نتيجة زراعة محاصيل مختلفة
مصادر النتروجين السمادية:
العضوية:
وتشمل مخلفات الاغنام والخيول والابقار والمجازر ومصانع الاغذية وبقايا النباتات في الحقل والاسمدة الخضراء.
الاسمدة النتروجينبة الطبيعية:
املاح نترات الصوديوم والكالسيوم والغنيسيوم.
الاسمدة الصناعية:
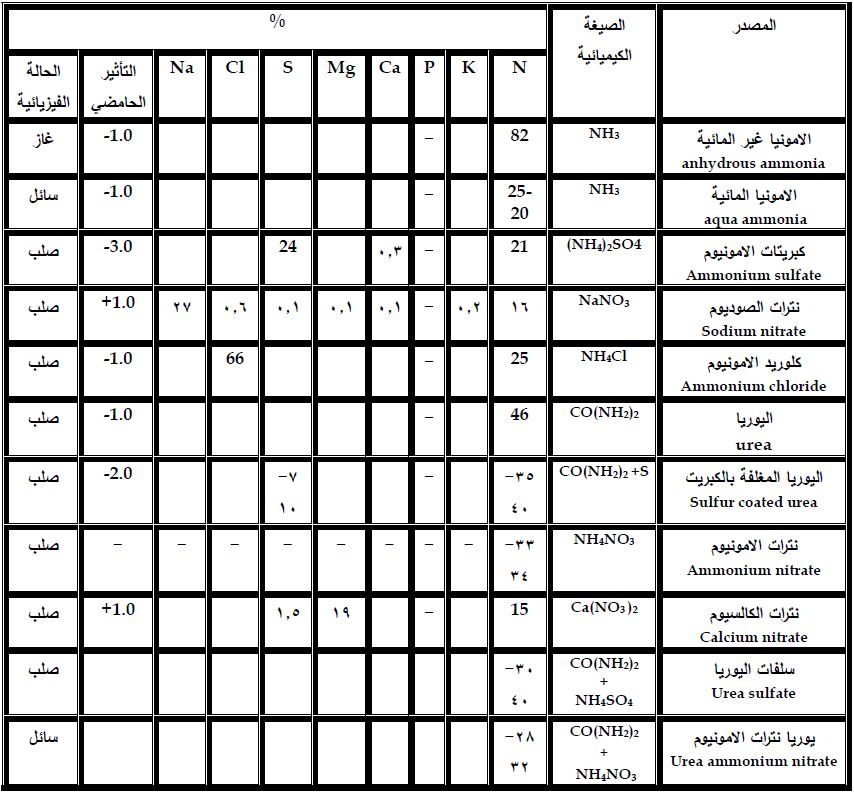
بشكل عام يمكن تقسيم الاسمدة النتروجينية الى اسمدة امونياكية او حاوية على الامونيوم واسمدة نتراتية او حاوية على النترات. والجدول 2 يبين بعض الاسمدة النتروجينية شائعة الاستعمال.
تعد الامونيا الحجر الاساس لمعظم الاسمدة النتروجينية المصنعة او المشتقة كيميائياَ. ان معظم الامونيا تنتج من تفاعل غاز النتروجين وغاز الهيدروجين وكما يأتي:
عوامل مساعدة
3NH2 + N2 ------------------>2NH3
500-1200 درجة مئوية و 500 اتموسفير
النتروجين يحصل عليه من امرار الهواء الجوي في فرن التسخين والهيدروجين بالأساس طبيعي وجز منه من غازات الفرن الغنية بالميثان وغاز الميثان يحوي 50 % هيدروجين. غازات النتروجين والهيدروجين النقية (بنسبة حجم نتروجين الى ثلاث حجوم هيدروجين) تضغط بالتدريج تحت ضغط عالي وتوضع في المرمدة بوجود المادة المساعدة .الحرارة المستعملة من 500 – 1200 درجة مئوية والضغط بحدود 500 ضغط جوي (50000 كيلو باسكال) وبوجود الحديد عاملاَ مساعداَ.
الامونيا المصنعة تستخدم في انتاج املاح الامونيوم وحامض النتريك. حامض النتريك الذي يعد الاساس في صناعة اسمدة النترات يصنع من اكسدة الامونيا مع الاوكسجين وكما في التفاعلات الاتية:
4NH3+5O2 ------------- > 4NO+6H2O
2NO+ O2------------ > 2NO2
2NO2+H2O< ========> HNO3+HNO2
الامونيا غير المائية: Anhydrous Ammonia
وهي اسمدة عالية المحتوى من النتروجين (82% N) وتعد من اكثر الاسمدة استخداماَ في الدول المتقدمة لاسيما في اميركا الا انها تحتاج الى معدات خاصة لأضافتها لأنها بشكل غاز وتفقد مباشرةَ اذا ما اضيفت الى سطح التربة .لذا الطريقة السليمة لإضافتها هي الحقن تحت سطح التربة بمسافة 20-7.5سم واضافة الماء بعد ذلك للتقليل من تطايرها. وهذه الإضافة تحتاج الى حاقنات خاصة والى خبرة في الاضافة، هذا فضلا عن ان عملية نقل الامونيا غير المائية يتطلب عربات حوضية خاصة لنقل الامونيا تحت ضغط وتبريد يصل الى 33 درجة تحت الصفر. ولهذا فأن استعمال هذه الاسمدة محدود او شبه معدوم في الدول النامية. كما يشترط ان تؤخذ الاحتياطات المطلوبة اثنا عملية الاضافة ولاسيما توفير معدات الوقاية من قفازات ونظارات ومياه.
الامونيا المائية (المسيلة): Aqua Ammonia
يتم تحضيرها من ادخال غاز الامونيا بقوة الى الماء وهي اسهل بالنقل والاضافة الا انها تضاف حقناَ لعمق 10-5 سم. تحوي هذه الامونيا نتروجين بحدود 25 - 29%. وتستعمل للإضافات المباشرة او لإنتاج اسمدة سائلة اخرى.
جدول 2 يبين بعض الاسمدة النتروجينية شائعة الاستعمال
محاليل النتروجين Nitrogen Solutions:
وهي محاليل محضرة بدون ضغط ومن اكثر الاسمدة النتروجينية السائلة انتشاراَ ومن اهم محاسنها :
اسهل وآمن في النقل والتوزيع
ذات قابلية جيدة للخلط مع الاسمدة الاخرى ومع المبيدات
كلف انتاجها اقل من الاسمدة الصلبة .
وعموماَ تنتج هذه الاسمدة من اليوريا ونترات الامونيوم والماء وتعرف Urea Ammonium Nitrate (UAN).
اليوريا: Urea
من اهم الاسمدة النتروجينة وتحوي (46 % N) ولذا تعد الاعلى في المحتوى من النتروجين بين الاسمدة النتروجينة الصلبة.
تحضر اليوريا من الامونيا او النتروجين الجوي وثنائي اوكسيد الكاربون كما يأتي
CO2+2NH3---------------CO (NH2)2+H2O
وهي ذات تفاعل قاعدي في البداية الا انها في النهاية ذات تأثير حامضي بعد حدوث عملية النترجة وتحول الامونيوم الى النترات. وتعد اليوريا من الاسمدة المفضلة لدى المزارعين واثبتت نجاحها وتفوقها في ترب العراق حتى على بعض الاسمدة المنتجة للحموضة مثل كبريتات الامونيوم (فتح الله 1978). بعد اضافة اليوريا الى التربة تتحول اليوريا الى الامونيوم بمساعدة انزيم اليوريز (وهو انزيم موجود في معظم الترب ولا توجد حاجة لإضافته)، لأن اليوريا بالأصل سماد عضوي الا انها مصنعة و بعد التحلل تسلك اليوريا سلوك الامونيوم .اليوريا من الاسمدة المعرضة للفقد بالتطاير وللتقليل من هذا الفقد تضاف اليوريا بشكل حزم (تلقيم) ويضاف الماء (الري) بعد التسميد. كما يمكن تقليل الفقد باستخدام مثبطات اليوريز الذي يؤخر من تحلل اليوريا ويقلل من التطاير. وهنا الجدوى الاقتصادية يجب ان تؤخذ بنظر الاعتبار. وهناك مادة سامة تسمى البيوريت biuret تتكون مع اليوريا اثنا التصنيع والخزن غير الجيد وارتفاع درجات الحرارة (كما في المعادلة الاتية) وهذه المادة يجب ان لا تتجاوز نسبتها 1% في اليوريا الا ان نسب بحدود 1.5% مقبولة عالمياَ لليوريا التي تضاف الى التربة وبحدود 0.25% لليوريا التي تضاف رشاَ على الجزء الخضري لاسيما للمحاصيل الحساسة.. وتعد صناعة اليوريا في العراق متطورة وهناك مصنع في البصرة ومصنع في بيجي وذات مواصفات ممتازة. وتصنع اليوريا في العراق وفق المواصفات العالمية وبنسب بيوريت لا تتجاوز 1%. اليوريا تمتص الرطوبة من الجو ويجب ان تعبأ وتنقل بأكياس خاصة مانعة للرطوبة.
CO(NH2)2 +CO(NH2)2 ---> NH2-CO-NH-CO-NH2 + NH3
سلوك اليوريا في التربة:
عند اضافة اليوريا للتربة تتحلل مائياَ كما يأتي:
انزيم اليوريز .
CO (NH2)2+H2O+H---------------> 2NH4+HCO3
NH4 -----------> NH3 +H
Or
CO (NH2)2+H2O+H---------------> (NH4)2CO3
+(NH4)2CO3-------------->2NH3 +CO2
ودرجة تفاعل التربة (pH) هي المسيطرة والمحددة للتحول من NH4 الى NH3 وبالعكس .التحلل المائي يتسارع في الترب الدافئة والرطبة والتحول الى الامونيوم يتم بحدود 3-4 يوماَ. انزيم اليوريز متوافر في معظم الترب وهناك العديد من احياء التربة المجهرية التي تفرز اليوريز. ولذا يزداد اليوريز مع زيادة نشاط الاحياء المجهرية والمحتوى من المادة العضوية. كذلك وجود النباتات الطرية ينتج كمية وافرة من اليوريز. وعموماَ نشاط اليوريز يكون على اقصاه في منطقة المحيط الجذري (الرايزوسفير). عند ارتفاع درجة تفاعل الوسط pH)) لاسيما اعلى من 7.5 فان تثبيطاَ وقتياَ ممكن ان يحدث لليوريا ناتج عن الامونيا الحرة المتواجدة احياناَ تحت هكذا ظروف وهذا ممكن ان يؤدي الى تثبيط وقتي لعملية تحلل اليوريا. بشكل عام تأثير اليوريا يكون قاعدي في البداية الا انه وبمرور الوقت وحدوث عملية النترجة يكون التأثير حامضي اي التأثير النهائي لإضافة اليوريا للتربة هو حامضي.
ادارة سماد اليوريا:
ادارة جيدة مطلوبة للتقليل من طاقة فقد الامونيا وهناك عدد من الوسائل منها:
* يفضل وضع اليوريا بمسافة عن البذور كي لا يكون هناك تأثير مباشر للامونيا المتحررة في انبات البذور والمسافة هنا بحدود 2.5 سم. كما ان كمية اليوريا المضافة قرب البذور يجب ان لا تتجاوز 11 كغم للهكتار لاسيما في الترب الكلسية. ومع هذا يمكن زيادة كمية الاضافة عند ت وافر ظروف الرطوبة المناسبة.
* خلط اليوريا مع التربة السطحية واضافة الماء او الري بعد الاضافة مباشرةَ يقلل من الفقد بالتطاير.
كبريتات الامونيوم (سلفات الامونيوم): Ammonium Sulfate
NH3 + H2SO4 -------------> (NH4)2SO4
سماد يحوي 20.5-21% نتروجين وينتج من معادلة حامض الكبريتيك مع الامونيا كما في المعادلة الاتية :
H2SO4+NH3 ========> (NH4)2SO4
وتفصل بالطرد المركزي وتجفف واحياناَ ممكن تعويض حامض الكبريتيك بالجبس. وهو من الاسمدة المولدة للحموضة وقليل التعرض للفقد بالتطاير. وهذا السماد له صفات فيزيائية جيدة اذ انه لا يتكتل في الخزن ويكمن استعمال الباذرة المسمدة بكفاءة في اضافته لا سيما وان امتصاصه للرطوبة واطئ.
تفاعل كبريتات الامونيوم في التربة:
الاكسدة البايولوجية:
NH4)2SO4 +4 O2 ===== HNO3 + H2SO4)
هذه الحوامض تتعادل في التربة بدخولها بتفاعلات مع البيكاربونات في محلول التربة والايونات الموجبة في معقد الامتزاز والتي تنتهي بانخفاض pH التربة. وعموماَ النباتات تأخذ الامونيوم بكميات اكبر واسرع من الايونات السالبة ومن ثم تزداد الحامضية.
كلوريد الامونيوم Ammonium Chloride:
يحوي 24 - 25% N وهو ناتج ثانوي لصناعة الصودا:
NH3+CO2+H2O+NaCl ===== NaHCO3+NH4Cl
سماد ذائب بالماء وله صفات خزنية جيدة ولا يتكتل بالخزن. له تأثير فسيولوجي حامضي ويحوي على 66.6 % كلور. احتواءه على الكلورايد يقلل من قيمته السمادية لاسيما للبطاطا والتبغ والاعناب اذ يؤثر سلباَ في نوعيتها. وعموما يجب عدم اضافته للمحاصيل الحساسة للكلورايد ويفضل ان يضاف بمدة كافية قبل الزراعة كي يغسل الكلورايد من منطقة الجذور. مع هذا لبعض الترب ولبعض المحاصيل جودة هذا السماد لا تقل عن كبريتات الامونيوم.
الاسمدة الحاوية على النترات:
نترات الامونيوم Ammonium Nitrate
HNO3 + NH3 -------------- NH4NO3
سماد سهل الذوبان بالماء وجاهزية عالية للنبات وهو ملائم لمعظم المحاصيل.
نترات الكالسيوم: Calcium Nitrate
ينتج هذا السماد من معادلة 40-48% محامض نتريك مع كاربونات الكالسيوم
HNO3 + CaCO3 ------------- Ca(NO3)2 + CO2 + H2O
وهو سماد جيد الا انه ذا تأثير متعادل الى قاعدي. وبشكل عام اسمدة النترات وعلى الرغم من كونها اسمدة جيدة المواصفات الا ان هذا السماد يمتص الرطوبة بدرجة عالية ولذا يجب ان يحفظ في اكياس لا تسمح للماء بالدخول ومدعمة بمواد خاصة. ولتقليل امتصاصه للرطوبة يخلط مع مواد كارهة للماء وعادةَ يمزج اثناء التصنيع مع نترات الامونيوم. نسبة النتروجين الواطئة(14.86 % N ) جعلته غير اقتصادي ومكلف بالنقل.
نترات الصوديوم Sodium Nitrate:
يطلق عليه ملح بيتر ويحوي 15-16% نتروجين و 26% صوديوم ويصنع كما في المعادلات الاتية :
Na2CO3+2NO2 ===== NaNO3 + NaNO2 + CO2
3NaNO2 +2HNO3 ===== 3 NaNO3 + 2NO+H2O
نترات الصوديوم: تمتص الرطوبة بشكل كبير وتتكتل اثنا الخزن. عند خزنه بشكل جيد في جو جاف وظروف ملائمة يبقى بشكل محبب وسهل الاضافة للتربة.
تفاعل نترات الصوديوم والكالسيوم في التربة:
بعد الاضافة مباشرةَ تذوب هذه الاسمدة بسهولة وسرعة .النترات تبقى بشكل متحرك ولا تتعرض الى اي امتصاص كيميائي او فيزيوكيميائي او بتعبير اخر لا تمتز بالتربة ولذا تكون معرضة للفقدان بالغسل لاسيما تحت ظروف المناطق الممطرة والاستوائية او الري الثقيل في المناطق المروية. وهنا تأتي اهمية وقت اضافة السماد وتجزئة اضافته.
اسمدة نترات الصوديوم والكالسيوم اسمدة قاعدية من الناحية الفسيولوجية لأن النبات يمتص النترات بكميات اكبر من الكالسيوم والصوديوم ولذا تبقى هذه الايونات بالتربة وتزيد من قاعديتها .
البنجر السكري والمحاصيل الجذرية عموماَ تستجيب لإضافة نترات الصوديوم لحاجتها للصوديوم والتأثير هنا في كمية ونوعية الانتاج. كما ان نترات الكالسيوم مهمة في الترب الحامضية. ومع هذا نتر ات الصوديوم غير مفضلة في الترب الملحية والصودية.
وبشكل عام اسمدة النترات وعلى الرغم من كونها اسمدة جيدة المواصفات الا انها محدودة الاستعمال ومحرمة الاستعمال في بعض الدول لأن النترات تدخل في صناعة البارود (الأسلحة) وهناك متطلبات خاصة للنقل والخزن خوفاَ من الانفجار. كما ان هذه الاسمدة تمتص الرطوبة بدرجة عالية ولذا يجب ان تحفظ في اكياس لا تسمح للما بالدخول ومدعمة بمواد خاصة.
مركبات النتروجين بطيئة التحرر (او بطيئة الجاهزية):
وهي مركبات واطئة الذوبان بالماء ويجب ان تمر بتحلل كيميائي او حيوي لكي يتحرر النتروجين للنبات. والهدف من تصنيع هذه الاسمدة هو لزيادة كفا ة استعمال الاسمدة النتروجينية والتي يفقد منها الكثير من خلال التطاير وعكس النترجة والغسل. ومن المواد المستعملة للتقليل من فقدان النتروجين او بتعبير اخر السيطرة على تحرره هي مثبطات النترجة ومثبطات اليوريز او استخدام مركبات واطئة التحلل بالماء.
1. مثبطات النترجة واليوريز:
مثبطات النترجة Nitrification Inhibitors :وهي مواد ذات تأثير سمي او تثبيطي لبكتريا النترجة وبالتالي تعيق عملية النترجة لمدة معينة وتقلل من تحول الامونيوم الى النترات وبالتالي تقلل من الفقد بصيغة النترات. ومن اهم شروط اختيار المثبط ان يكون تأثيره نوعي في احيا النترجة فقط وكلفته الاقتصادية مناسبة. ومن اهم مثبطات النترجة ما يعرف بحافظ النتروجين N serve او النتروبايرين والنتروبيرميدين. وهذه المركبات تنتج من قبل شركة اميركية تدعى Dow company وهناك منتج ياباني ايضَاَ (Ali,1983 والشماع 1997).
2- مثبطات اليوريز Urease inhibitors:
من هذه المثبطات NBPT و Ammonium Thiosulfate )السالم 1997).
3- مركبات واطئة التحلل بالماء - low Water Soluble Compounds:
ومنها اليوريا المغلفة بالكبريت Sulfur Coated Urea (SCU) يوريا مغلفة بطبقة من الكبريت تحوي 22-38% N. وهي من الاسمدة التي اثبتت كفاءتها لاسيما عندما يكون التغليف جيداَ وممكن ان تعد سماد اَ نتروجينياَ وكبريتياَ اذ انها تحوي على 12 - 22 % كبريت. (الحلي 2007 والعابدي واخرون 2007). وهناك استعمال لمواد عضوية ومعقدات للتقليل من فقدان النتروجين.
وهناك معادلة يمكن من خلالها حساب معامل الفعالية لهذه الاسمدة وكما يأتي:
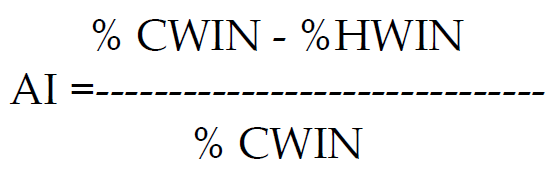
حيث ان: AI :دليل الفعالية
CWIN: الجزء غير الذائب بالماء البارد
HWIN: الجز غير الذائب بالماء الحار
تأثيرات عامة للأسمدة النتروجينية ممكن ان تشمل:
تغيرات محتملة في درجة تفاعل التربة
زيادة الفعالية الحيوية
تأثيرات ملحية عند الاضافة بمستويات عالية (لاسيما عند اضافة كلوريد البوتاسيوم وفي الترب غير الملحية).
بعض التأثيرات السمية للأمونيا الناتجة من بعض الاسمدة الامونياكية لاسيما التأثير في البادرات.
 الاكثر قراءة في الاسمدة
الاكثر قراءة في الاسمدة
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة


