
تاريخ الفيزياء

علماء الفيزياء


الفيزياء الكلاسيكية

الميكانيك

الديناميكا الحرارية


الكهربائية والمغناطيسية

الكهربائية

المغناطيسية

الكهرومغناطيسية


علم البصريات

تاريخ علم البصريات

الضوء

مواضيع عامة في علم البصريات

الصوت


الفيزياء الحديثة


النظرية النسبية

النظرية النسبية الخاصة

النظرية النسبية العامة

مواضيع عامة في النظرية النسبية

ميكانيكا الكم

الفيزياء الذرية

الفيزياء الجزيئية


الفيزياء النووية

مواضيع عامة في الفيزياء النووية

النشاط الاشعاعي


فيزياء الحالة الصلبة

الموصلات

أشباه الموصلات

العوازل

مواضيع عامة في الفيزياء الصلبة

فيزياء الجوامد


الليزر

أنواع الليزر

بعض تطبيقات الليزر

مواضيع عامة في الليزر


علم الفلك

تاريخ وعلماء علم الفلك

الثقوب السوداء


المجموعة الشمسية

الشمس

كوكب عطارد

كوكب الزهرة

كوكب الأرض

كوكب المريخ

كوكب المشتري

كوكب زحل

كوكب أورانوس

كوكب نبتون

كوكب بلوتو

القمر

كواكب ومواضيع اخرى

مواضيع عامة في علم الفلك

النجوم

البلازما

الألكترونيات

خواص المادة


الطاقة البديلة

الطاقة الشمسية

مواضيع عامة في الطاقة البديلة

المد والجزر

فيزياء الجسيمات


الفيزياء والعلوم الأخرى

الفيزياء الكيميائية

الفيزياء الرياضية

الفيزياء الحيوية

الفيزياء العامة


مواضيع عامة في الفيزياء

تجارب فيزيائية

مصطلحات وتعاريف فيزيائية

وحدات القياس الفيزيائية

طرائف الفيزياء

مواضيع اخرى
الغليان وحرارة التبخير
المؤلف:
فريدريك بوش ، دافيد جيرد
المصدر:
اساسيات الفيزياء
الجزء والصفحة:
ص 406
27-6-2016
19344
الغليان وحرارة التبخير
من المعلوم أن جزيئات السائل تؤثر على بعضها البعض بقوى تجاذبية متبادلة قوية إلى حد ما. (قوى التجاذب ذات طبيعة كهربائية اساساً ). وإذا نظرنا غلى الجزيئات الموجودة على سطح السائل سنجد ان الغالبية العظمى منها لا تستطيع الهرب إلى المنطقة الواقعة خارج السطح. ولكن، كما في حالة الغازات، يحدث أن يكتسب القليل من هذه الجزيئات طاقة كبيرة جداً بسبب الحركة الحرارية. ونتيجة لذلك يمكن أن تهرب مثل هذه الجزيئات من سطح السائل متحولة بذلك من الحالة السائلة إلى الحالة الغازية، وتسمى هذه العملية بالتبخير أو التصعيد.
ونظراً لأن أعلى الجزيئات طاقة هي وحدها التي تهرب من السطح، فإن ذلك يؤدي إلى نقص متوسط طاقة الجزيئات المتبقية مع استمرار عملية التبخر. ومن ثم فإن درجة حرارة السائل المعزول يجب ان تقل نتيجة للتبخر؛ وذلك لأن درجة الحرارة، كما نعلم، مقياس لطاقة حركة الجزيئات. وهكذا نكون قد وصلنا إلى تفسير تلك الحقيقة المعروفة بان التبخر يسبب تبريداً للسائل.
بناء على ذلك يمكن القول أنه إذا أريد لجزيئات السائل أن تهرب من سطح السائل فإن من الضروري تزويدها بالطاقة اللازمة. وتعرف كمية الطاقة اللازمة لذلك ، والتي تختلق من مادة إلى أخرى، باسم حرارة التبخير، وتعريفها كالتالي:
تسمى الطاقة اللازمة لتحويل وحدة الكتلة من المادة من الطور السائل إلى الطور البخاري ( الغازي) بحرارة تبخير (Hv) تلك المادة.
(1) Q = mHv
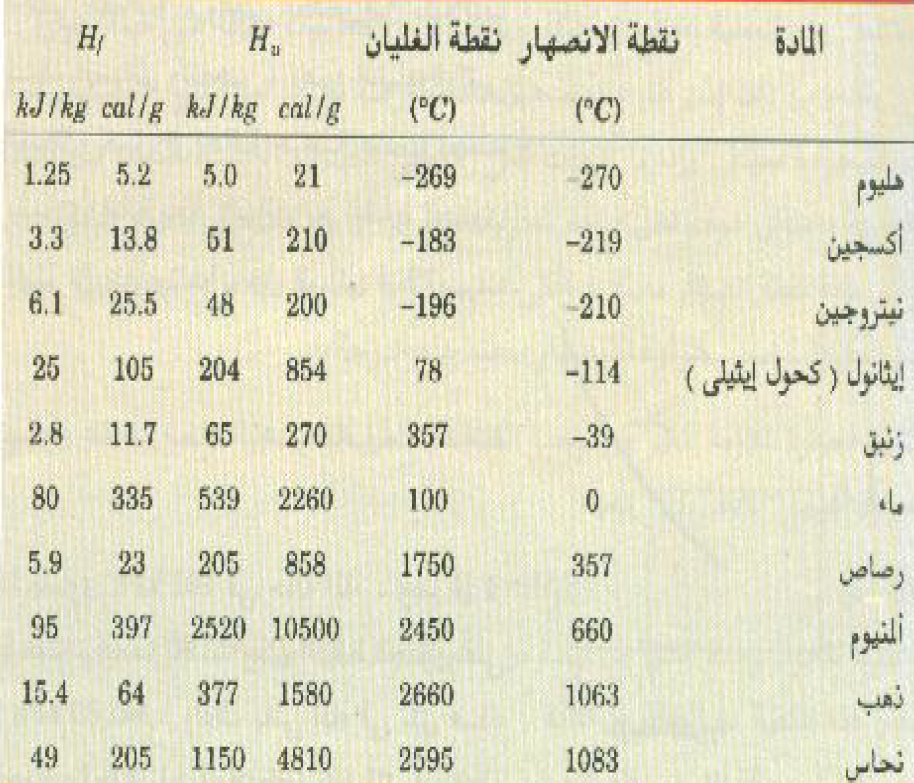
وعندما تتكثف وحدة الكتلة من المادة من الطور البخاري إلى الطور السائل سوف تنطلق نفس هذه الكمية من الطاقة من المادة؛ ويوضح الجدول 1)) قيم Hv لبعض المواد المألوفة.
الجدول 1)) حرارة التبخير وحرارة الانصهار لبعض المواد المألوفة
يغلي السائل عندما تتكون الفقاعات البخارية وتنمو داخله. ولكي يمكننا فهم ما يحدث في هذه العملية يجب ان نفهم اولاً ما هو ضغط البخار. لفرض أن دلينا سائلاً وبخاره في إناء مغلق كالمبين بالشكل 1)). في مثل هذا الموقف يتحقق الاتزان بين السائل وبخاره عندما يتزن عدد الجزيئات المتبخرة من السائل مع عدد الجزيئات المتكثفة من البخار إلى السائل. ويسمى ضغط بخار السائل في حالة الاتزان هذه بضغط البخار ( أو الضغط البخاري) للسائل. وبالطبع فإن ضغط البخار يزداد بزيادة درجة الحرارة. لماذا ؟

الشكل ((1: عندما يكون البخار مشبعاً داخل إناء مغلق، يتساوى عدد الجزيئات المتبخرة من السائل تماماً مع عدد الجزيئات المتكثفة من البخار إلى السائل.
لنفرض الآن أن لدينا كمية من سائل في إناء مفتوح بحيث يقطع سطحه تحت تأثير الضغط الجوي كما هو مبين بالشكل 2))، ولننظر هذه المرة إلى الجزيئات الموجودة داخل السائل. ونظراً للحركات العشوائية للجزيئات داخل السائل، يحدث بين حين وآخر أن تكتسب مجموعة من الجزيئات كمية كافية من الطاقة لفصلها عن بعضها البعض، وبذلك يتكون حيز خال، أو ثقب، داخل السائل، وعندئذ تتبخر بعض الجزيئات من السائل إلى الثقب، ومن ثم يرتفع ضغط البخار داخله. وبمرور الوقت يمكن ان يصل ضغط البخار داخل الثقب إلى قيمة مساوية لضغط البخار عند درجة حرارة السائل. فإذا كانت درجة الحرارة منخفضة سيكون الضغط داخل الثقب صغيراً مما يؤدي إلى ضموره وفنائه تحت تأثير الضغط الجوي على سطح السائل. أما إذا كانت درجة الحرارة مرتفعة فسوف يكون الضغط داخل الثقب الكبير، ربما اكبر من الضغط داخل السائل نتيجة لتأثير الضغط الجوي. وفي هذه الحالة سوف تتسبب الزيادة في الضغط داخل الثقب، الذي أصبح الآن فقاعة مليئة بالبخار، في تمدد الفقاعة. وتحت تأثير قوة الطفو المؤثرة على الفقاعة، وعلى الكثير من مثيلاتها الأخريات، سوف ترتفع الفقاعة إلى سطح السائل وتنفجر، وهي الظاهرة التي نعرفها باسم الغليان. وهكذا نرى أن السائل يصل إلى حالة حرجة عندما تصبح درجة الحرارة عالية كافية لكي يتساوى ضغط بخار السائل مع الضغط الجوي فوق سطحه. وعندئذ تتكون الفقاعات المليئة بالبخار وتنمو داخل السائل فيما يعرف بالغليان.
يغلى السائل عند درجة الحرارة التي يتساوى عندها ضغط البخار تماماً مع الضغط الخارجي على السائل.
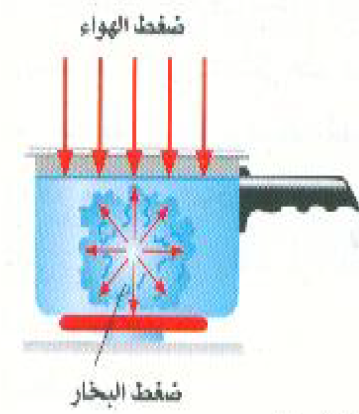
الشكل 2)): درجة الغليان هي درجة الحرارة التي يتساوى عندها ضغط البخار داخل الفقاعة مع الضغط الخارجي المؤثر على السائل. (حجم الفقاعة مبالغ في تكبيرة).
وحيث أن ضغط البخار عند درجة 100oC يساوي 101 kPa في حالة الماء، وبما أن1 atm = 101 kPa ، فإن الماء يغلى عادة عند درجة 100oC. ولكن يغلي الماء في مثل هذه المناطق عند حوالي94oC . هذا ويمثل الجدول 1)) نقط غليان بعض السوائل المعروفة عند الضغط الجوي المعتاد (PV = 101 kPa). وبقياس نقطة عليان المادة عند ضغوط محيطة مختلفة وتمثيل النتائج بيانياً سوف نحصل على منحني كالمبين بالشكل 3)) في حالة الماء؛ ويعرف الخط الفاصل بين السائل والبخار باسم منحني التبخير، نرسم خطاً أفقياً عند هذا الضغط ثم نوجد نقطة تقاطعه مع المنحني. وبإسقاط عمود من نقطة التقاطع هذه على المحور الأفقي سوف نحصل على درجة الغليان المطلوبة عند الضغط المعنى. ومن الجدير بالذكر أن الغليان مثال لما يسمى تغير الطور، ولذلك يسمى الشكل 3)) برسم بيان الطور. لاحظ من الشكل ( (3أن درجة غليان الماء ترتفع بارتفاع الضغط عليه.
من المهم أن نفهم تماماً أنه عندما تمر عينة من المادة بعملية تغير في الطور فإن الحرارة المضافة إلى المادة او الملفوظة بواسطتها لا تغير درجة حرارة المادة غلى أن يتغير طور العينة بأكملها إلى الطور الجديد. فإذا ما أشعل الموقد تحت قدر من الماء المغلي فإن ذلك سوف يسبب غليان الماء بشكل اكثر عنفاً، ولكن درجة الحرارة لن ترتفع. ذلك أن الحرارة المصاحبة لتغير طور المادة من سائل إلى غاز تتحدد بكتلة العينة وحرارة تبخير المادة تبعاً للمعادلة (1).

الشكل 3)): منحني تبخير نموذجي. يحدث الغليان عند درجة TA عندما يكون الضغط PA وترتفع نقطة الغليان إلى TB عند زيادة الضغط إلىPB .
 الاكثر قراءة في خواص المادة
الاكثر قراءة في خواص المادة
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة

الآخبار الصحية















 قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة
قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة "المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة
"المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة (نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)
(نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)


















