
المواد القاعدية
 المؤلف:
كاثى كوب ومونتى فيتيرولف
المؤلف:
كاثى كوب ومونتى فيتيرولف
 المصدر:
روعة الكيمياء العلم المذهل للاشياء المألوفة
المصدر:
روعة الكيمياء العلم المذهل للاشياء المألوفة
 الجزء والصفحة:
ص95
الجزء والصفحة:
ص95
 7-4-2016
7-4-2016
 16778
16778
المواد القاعدية
اطلب من آسيا كوبا من الكريمة اللاذعة فستكون كعكتك خفيفة وبدون الكثير من الصودا، وما لا أحبذه هو الطلب الأول. لقد اندفع ديمي إلى الطابق السفلي ثم عاد بالكريمة وبوجه عابث لأنه تذوقها وهو في الطريق ووجدها لاذعة جدا حتى إنه توقع أن الكعكة ستكون غير صالحة للأكل. اقتبست السيدة جو هذه الواقعة لتلقي محاضرة قصيرة وهي على السلم عن الخواص الكيميائية للصودا، ولم تنصت إليها ديزي، لكن ديمي أصفى إليها وفهمها كما يتضح من رده الذي كان مختصرا لكنه شامل إذ قال: نعم، أنا أفهم، فالصودا تحول الأشياء اللاذعة إلى أشياء مذاقها حلو، وإذا أخفقت في عملها فستكون خفيفة، فلنشاهدك وأنت تقومين بإعدادها يا ديزي. (الروائية لويزا ماي الكوت في كتابها رجال صفار ١٨٧١)
يعد تفاعل دمي اللاذع - الحلو، أما الحلو في الاقتباس السابق فهو تفاعل حامضي - قاعدي. فبيكربونات الصودا قاعدية (كما وجدنا في تجربة دليل الكرنب الأحمر)، والكريمة اللاذعة هي خليط حامضي: فالكريمة اللاذعة تكون لاذعة بسبب النواتج الحامضية الناجمة عن فعل البكتريا. وقد شاهدنا في تجربة صاروخ الزجاجة محلول حامضي آخر وهو الخل الذي يلتقي ببيكربونات الصودا ويؤدي إلى تفاعل انفجاري، وما جعل كعكة ديزي خفيفة هو ذلك النوع من التفاعل نفسه لكن بمستوى أبسط:
الحامض + بيكربونات الصودا ← حامض الكربونيك ← ثاني أكسيد الكربون (غاز) + ماء
يتفاعل الحامض مع بيكربونات الصودا وينتج حامض الكربونيك الذي يتحول سريعاً إلى ثاني أكسيد الكربون وماء. وثاني أكسيد الكربون هو الغاز الذي تسبب في دفع السدادة في تجربة صاروخ الزجاجة وهو الذي أحدث الفقاقيع في كعكتنا الصغيرة الرقيقة. والسبب الذي جعلنا ننبهك لشراء بيكربونات الصودا في قائمة المشتريات والمحاليل بدلا من البيكينج بودر هو أن البيكينج بودر يحوي مركبا حامضياً مثل كريمة الطرطير. وتعمل كريمة الطرطير كعامل للتخمير بمعنى أنها عندما تذوب في الماء مع بيكربونات الصودا فإنهما يتفاعلان ويكونان فقاقيع.
ولا تنتج كل التفاعلات الحامضية القاعدية مثل هذه النواتج المتطايرة، ويعد الخل حامضا يدل على ذلك تغير لونه إلى اللون الوردي عند إضافة دليل الكرنب الأحمر. أما النشادر فهي قاعدية بسبب تغير لونها إلى اللون الأزرق عند إضافة دليل الكرنب الأحمر، لكن عند إضافة الخل والنشادر معاً بدون إضافة الدليل، لا تحدث أمارات التفاعل الكيميائي المعتادة، فلا يكون هناك أدخنة جديدة ولا رغاو ولا انبعاث للحرارة أو للضوء ولا تغيير في اللون ولا تكوين مواد صلبة، ولولا الرائحة النفاذة للخل والرائحة الفجة للنشادر، لبدا الأمر كأنه مجرد إضافة سائلين مائيين شفافين معّا. لكن إذا أضيف ملعقة شاي (٥ مليلتر) من دليل الكرنب الأحمر إلى كوب (٢٤٠ مليلتر) يحوي واحدا منهما فقط قبل إضافتهما معا، تكون النتيجة تغير لون المحلول، ويستخدم الدليل ليبين حدوث التفاعل الكيميائي عندما لا توجد علامات أخرى واضحة.
ما هي الأحماض وما هي القواعد إذن؟ الخل فعلياً هو محلول مخفف لحامض الخليك في الماء، ما يقرب من ٥ % محلول، لكنه يستطيح أن يبرز بدقة الخواص المميزة للحامض: فهو لاذع ويحول دليل الكرنب الأحمر إلى اللون الأحمر أو الوردي، ويتفاعل مع القاعدة ليكون الماء. ويبرز محلول بيكربونات الصوديوم بشدة العديد من الخواص المميزة للقاعدة: فهو مر المذاق، ويحول دليل الكرنب الأحمر إلى اللون الأزرق، ويتفاعل مع الحامض ليكون الماء. وتعتبر آخر خاصية مذكورة لكل منهما فيما يخص تفاعلهما معاً هي بالفعل الخاصية المحددة لكل منهما، لأن التفاعلات الحامضية القاعدية تحدث في الوقت نفسه، شأنها في ذلك شأن تفاعلات الأكسدة والاختزال: فمادة واحدة تتفاعل كحامض ومادة واحدة تتفاعل كقاعدة، والحامض يعادل القاعدة والقاعدة تعادل الحامض.
وقد أدرك الناس فكرة التعادل - إبطال خواص إحدى المواد بخواص مادة أخرى - منذ أن وصف أقدم دساتير الصيدلة قشر البيض المسلوق المسحوق كدواء مريح لمشكلات المعدة. وقشرة البيضة هي في الأصل كربونات الكالسيوم وهي نفس المادة التي تكون الطباشير، وهذه المادة لكونها قاعدية يمكنها أن تلغي تأثير الحموضة الزائدة في المعدة، وتنشأ هذه الحموضة طبيعيا في المعدة كي تساعد على هضم الطعام. وتسمى المواد القاعدية أيضا بالمواد القلوية، ويعزى جزء من هذه التسمية إلى القديم (فكلمةAlkaliهي كلمة عربية الأصل القلي مثل غيرها من الكلمات العربية الأصل أيضا مثل الخيمياء alchemy، والكحول alcohol، والجبر algeba ، والقبةalocve، واللوغاريتمalgoithm ويعزى جزء آخر إلى تجنب الارتباك، فعندما ندعو شيئا مادة قاعدية سيتبادر لأذهاننا أننا ندعوها مادة أسأسية وليس شيئا يتفاعل مع الحامض.
ويمكن أن نجد كثيرا من أمثلة التفاعلات الحامضية القلوية في الطهي مثل تفاعل كريمة الصودا اللاذعة المذكور في رجال صفار، علاوة على أنه من النتائج المؤسفة للأمطار الحامضية (التي سوف نناقش تركيبها فيما بعد) أن الحامض في المطر يتفاعل مع الكربونات الموجودة في الحجر الجيري والرخام الذي يسبب تآكل التماثيل التي تمكنت من النجاة بدون صدأ أو تحلل لآلاف السنين قبل مجيء عصر الصناعة. (وقبل أن نلقي باللوم التام على عصر الصناعة ينبغي أن نتذكر أيضا أن بكتريا الطاعون الأسود، والجدري، والزهري قد تمكنت من أن تنجو لعدة سنوات قبل أن تتمكن التكنولوجية الحديثة من أن تطيح بها.) وتبرز قدرة الأمطار الحامضية على إذابة الرخام خاصية أخرى مشتركة بين الأحماض والقلويات ألا وهي أنها مواد آكلة. ويتناول اقتباس قصة صاحب الظل الطويل لجين ويبستر الذي ذكرناه في المقدمة خاصية التآكل ونكرره هنا نظراً لملاءمته.
))علي أن أذهب إلى المعمل وأمعن النظر في بعض المواد من أحماض وأملاح وقلويات، لقد أحدث حامض الهيدروكلوريك ثقباً كبيرا بحجم الطبق في معطف المعمل من الأمام. إذا نجحت هذه النظرية فسأكون قادرا على معالجة هذا الثقب بالنشادر القوي، أليس كذلك؟))
(جين ويبستر في رواية صاحب الظل الطويل 1912)
وتكمن الدعابة في أن القاعدة تعادل الحامض، لذا يفترض طلاب الكيمياء أن استعمال القاعدة سيبطل تأثير الحامض ويعيد المادة المتلاشية من المعطف، ومن المثير أن تلحظ أن قراء أوائل القرن العشرين كان يفترض أنهم يفهمون المزحة دون الحاجة إلى شرحها، وأن طلاب الكيمياء في سنتهم الأولى في أوائل القرن العشرين كانوا يشجعون على استخدام مواد كيميائية نشطة بدرجة كافية حتى تعمل على تآكل المعطف. لكن مفهوم الحامضية أصبح مألوفا تماما في القرن الحادي والعشرين، فنحن نتحدث عن اللسان اللاذع والنقد اللاذع. وتمثل المحاليل الحامضية جزءا من مطابخنا، فالخل هو محلول حامض الخليك والليمون هو محلول حامض الستريك، كما تحتوي بيكربونات الصودا حامض الكربونيك. وتعتبر المواد والمحاليل القاعدية أيضا جزءا من خبرتنا العامة فالنشادر محلول قاعدي، ويستخدم اللي في إزالة الانسدادات من المصارف الصحية، وكثيرا ما نستخدم المصطلحات الأقدم كالقلي أو القلوي للإشارة إلى المواد القلوية مثل البطاريات القلوية أو ضبط قلوية مياه حمامات السباحة. ومرض القلاء وهو حالة خطيرة تزيد فيها نسبة القلوية في الدم بسبب نقص ثاني أكسيد الكربون، يمكن أن تسببه زيادة التهوية الرئوية.
وفي حقيقة الأمر لا يمكن للجسم البشري ككل أن يؤدي وظائفه بشكل جيد إلا ضمن نطاق محدود جدا للقلوية والحامضية، لكن قبل أن نلقي بالصلصة الساخنة من أجل المنفعة الصحية، كونوا متيقنين من أن الجسم البشري قد ابتكر طريقة لحفظ الدم عند مستوى القلوية الضروري المناسب للوظائف حتى إذا استخدم الخل في صلصة السلطة أو حتى إذا استنفدت المياه الغازية.
والدم منظم بسائل منظم للقلوية: وهو محلول ذي نسب في غاية الدقة مكون من أحماض ضعيفة وقواعد ضعيفة، من ثم لن تسبب إضافة النسب الضئيلة من الحامض أو القاعدة حدوث تغيير ملحوظ في درجة القلوية، وقد تكون أكياس الملاكمة تشبيه جيد للسوائل المنظمة، فقد يترنح الخصم غير المتزن إثر لكمة واحدة في مكان مؤثر، في حين أن كيس الملاكمة المتزن يمكنه أن يمتص لكمات عديدة ويرجع إلى وضعه مرة أخرى لاستقبال المزيد. وكذلك يكون الحال مع المحلول المنظم الذي يمكنه أن يمتص صدمات هجوم المزيد من الأحماض والقواعد ثم يرتد مرة أخرى إلى وضعه الأصلي تقريباً، ويمكن شرح هذا الموقف بسائل منظم آخر وهو اللبن.
خذ ووعائين شفافين صغيرين مما هو مطلوب في قائمة المشتريات والمحاليل، ثم أضف إلى كل منهما نصف كوب ( ١٢٠ مليلترا) لبناً كامل الدسم، ويجب استخدام لبن كامل الدسم لأن البقر لا يهتم كثيرا بشأن السعرات الحرارية ويوفر المحاليل المنظمة التي تكون اللبن كامل الدسم وغير المقشود. خذ وعائيين شفافين صغيرين آخرين ثم أضف إلى كل منهما نصف كوب (١٢٠ مليلترا) ماء. أضف إلى كل من الأوعية الأربعة عينات من دليل الفينول الأحمر من عبوة اختبار قلوية ماء حمامات السباحة ، ولا يصلح دليل الكرنب الأحمر لهذه التجربة لأنك ستضطر أن تضيف كميات كبيرة منه حتى يصبح اللون واضحاً، ويؤدي المزيد من السائل إلى تخفيف اللبن ومن ثم يحدث خلل في فاعلية السائل المنظم، أما عن دليل قلوية حمام السباحة، فإن إضافة المزيد منه تؤدي إلى إكساب اللبن والماء لونا أصفر باهتا.
والآن أضف قطرة من محلول بيكربونات الصودا السائل الذي يعلو المادة الصلبة غير المذابة إلى إحدى عينات الماء وإحدى عينات اللبن، وإذا كانت القطارة المستخدمة للعين متاحة فذلك أيسر لك، وإلا فيمكنك أن تضع ماصة في المحلول وتغطي طرف الماصة بإصبعك حتى يمكنك أن تجذب قطرة، ثم قلب المحاليل. ينبغي أن يتحول لون المحلول الذي يحوي الماء المضاف إليه بيكربونات الصودا إلى اللون الوردي الفاقع، في حين يظل لون المحلول الذي يحوي اللبن المضاف إليه بيكربونات الصودا كما هو أصفر باهتا دون أن يتغير.
وأفضل طريقة للمقارنة هي وضع الوعاءين على فرخ ورق أبيض والنظر مباشرة إلى الوعاء من أسفل، فثمة اختلاف جلي في لون المحلول الذي يحوي الماء والدليل قبل وبعد إضافة بيكربونات الصودا، في حين لا يتغير لون المحلول الذي يحتوي على اللبن والدليل قبل وبعد إضافة بيكربونات الصودا؛ فاللبن نظم تأثير بيكربونات الصوديوم أو عادله.
وثاني أكسيد الكربون هو الذي يقوم بعملية التنظيم هذه في الدم، وتعد بيكربونات الصودا أحد محاليل حامض الكربونيك المتكون عندما يصبح الماء مشبعا بثاني أكسيد الكربون، ولقد شاهدنا في تجربة الكرنب الأحمر أن بيكربونات الصودا هي حامضية بمعدل ضئيل. ويتشبع دم الإنسان بثاني أكسيد الكربون فهو الناتج النهائي لعملية الهضم، ويكون ثاني أكسيد الكربون حامض الكربونيك في الدم. وبيكربونات الصوديوم أو صودا الخبيز قاعدية كما رأينا في تجربة الكرنب الأحمر. وتنتج البيكربونات المكونة عن طريق إزالة جزء واحد من الهيدروجين من الكبد لتعمل كمادة قاعدية في الدم، ويستخدم ثاني أكسيد الكربون ليكون المواد الحامضية والقلوية في الدم، وعندما تزداد نسبة الحامضية في الدم ترتفع نسبة البيكربونات لتعادل الزائد من الحامض. وعندما تزداد نسبة القلوية في الدم، يعادل حامض الكربونيك الزيادة من القلوية. ولكن كما يتضح من إضافة محلول بيكربونات الصودا مباشرة إلى المحلول المكون من اللبن والدليل، لدى السوائل المنظمة قدرة محدودة لامتصاص الحامض أو القاعدة؟ فاللبن سيأخذ سريعا ظلاً وردياً من ذاته. وإذا كانت أطراف التوازن في الدم بعيدة جدا بطريقة ما، فإنه من الممكن حدوث القلاء أو الحموضة وهما حالتان طبيتان في غاية الخطورة.
ولا يعتبر الدم هو النظام الوحيد في الجسم الذي يستلزم وجود بيئة حمضقلوية (حامضية- قلوية) شديدة الاستقرار، فمادة الأسبرين المنظمة لسيولة الدم هي مادة أسبرين عدلت كي لا تصبح شديدة الحامضية فتهيج المعدة. وتمتزج الكثير من الشامبوهات والصابون على نحو خاص، من ثم لا تختلف حموضتها كثيرا عن حموضة البشرة أو الشعر. وإذا كان هناك اختلاف في خاصية الحموضة فإنها ستسبب تفاعلا حمضقاعدياً (حامضي-قاعدي) عند استخدامها، وقد يسبب التفاعل الحمضقاعدي تلفا الخلايا الحساسة للجلد أو للعين، مما يجعلك حريصا على استخدام القفاز ونظارة واقية العين عند إجراء هذه التجارب.
وقد يعلن عن المنتجات المتوازنة الحامضية أو القلوية تحت اسم متعادلة ph ، لكن ماذا تعنى (ph)؟ يمكنك أن تستدل على ذلك بالمرور مرة أخرى بعبوة اختبار قلوية حمام السباحة. يذكر دليل الفينول الأحمر تحت اسم دليلph أيضا، فتدل phعلى مقياس مدى حامضية المحلول أو قاعديته، فهي مقياس كمية الحامضية في المحلول.
ولأن ثمة الكثير من أزواج المواد التي تقوم إحداهما بتحسين الأخرى أو إبطال مفعولها، فثمة الكثير من المواد التي يمكن تصنيفها على أنها أحماض وقواعد. لكن سينصب تركيزنا على أكثر المجموعات شيوعاً وهي المواد التي تنتج أيونات الهيدرونيوم والهيدروكسيد المتعددة الذرات وهما أساس الحامضية والقاعدية في الماء، وكلمة متعدد تعنى أنه يحوي أكثر من واحد؟ فالأيونات متعددة الذرات هي أيونات تتألف من أكثر من ذرة، ينشأ أيون الهيدرونيوم من اتحاد أيون هيدروجين من الحامض مع الماء، ويكون للأيون الناتج متعدد الذرات شحنة موجبة: H3O+، ويتكون أيون الهيدروكسيد عندما تنتزع المادة القلوية ذرة هيدروجين من الماء، ويكون للأيون الناتج شحنة سالبة -OH. ويقيس مقياس (ph) عدد أيونات الهيدرونيوم الموجودة في عينة من المحلول؟ فالمحاليل الحامضية تحوي عدداً أكبر من أيونات الهيدرونيوم والمحاليل القلوية تحوي عدداً أقل. لاحظ إنه إذا كان من الممكن أن يتحد أيون هيدروكسيد مع أيون هيدرونيوم، فإن أيون الهيدروجين الزائد الموجود في أيون الهيدرونيوم يمكن أن يتحد مع أيون الهيدروكسيد، ومن ثم يمكن أن تلقي الشحنة الموجبة الشحنة السالبة، ويكون الناتج جزيئين من الماء، فالحامض والقاعدة يعادل أحدهما الآخر.

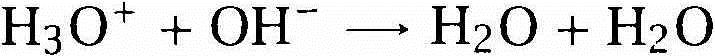
يتدرج مقياس (PH) من ٠ إلى ١٤ فعندما تساوي ٧ PH تكون متعادلة، ولا يعتبر مقياس (PH) مقياسا طوليا مثل المسطرة أو الترمومتر، لكنه نوع من أنواع المقياس اللوغاريتمي مثل مقياس ديسيبل، فهو يماثل موقف جودزيلا معاًبل الفأر الخارق الذي تعرضنا له من قبل عند عرض الانتشار النسبي للعناصر. وحتى نتمكن من أن نقيس المحاليل الحامضية والقاعدية في نفس الرسم البياني، علينا أن ننتقي مقياسا غير طولي. ووفقا لمقياس (PH) يعتبرالمحلول الذي يسجل ٣ تزيد قلويته ١٠ أضعاف المحلول الذي يسجل ٢، والمحلول الذي يسجل ٤ تزيد قلويته ١٠٠مرة عن المحلول الذي يسجل ٢ . ولنقولها بشكل أكثر بساطة، كلما ازداد مقياس (PH) زادت قلوية المحلول وقلت حامضيته.
 الاكثر قراءة في اخرى
الاكثر قراءة في اخرى
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة


