

علم الكيمياء

تاريخ الكيمياء والعلماء المشاهير

التحاضير والتجارب الكيميائية

المخاطر والوقاية في الكيمياء

اخرى

مقالات متنوعة في علم الكيمياء

كيمياء عامة


الكيمياء التحليلية

مواضيع عامة في الكيمياء التحليلية

التحليل النوعي والكمي

التحليل الآلي (الطيفي)

طرق الفصل والتنقية


الكيمياء الحياتية

مواضيع عامة في الكيمياء الحياتية

الكاربوهيدرات

الاحماض الامينية والبروتينات

الانزيمات

الدهون

الاحماض النووية

الفيتامينات والمرافقات الانزيمية

الهرمونات


الكيمياء العضوية

مواضيع عامة في الكيمياء العضوية

الهايدروكاربونات

المركبات الوسطية وميكانيكيات التفاعلات العضوية

التشخيص العضوي

تجارب وتفاعلات في الكيمياء العضوية


الكيمياء الفيزيائية

مواضيع عامة في الكيمياء الفيزيائية

الكيمياء الحرارية

حركية التفاعلات الكيميائية

الكيمياء الكهربائية


الكيمياء اللاعضوية

مواضيع عامة في الكيمياء اللاعضوية

الجدول الدوري وخواص العناصر

نظريات التآصر الكيميائي

كيمياء العناصر الانتقالية ومركباتها المعقدة


مواضيع اخرى في الكيمياء

كيمياء النانو

الكيمياء السريرية

الكيمياء الطبية والدوائية

كيمياء الاغذية والنواتج الطبيعية

الكيمياء الجنائية


الكيمياء الصناعية

البترو كيمياويات

الكيمياء الخضراء

كيمياء البيئة

كيمياء البوليمرات

مواضيع عامة في الكيمياء الصناعية

الكيمياء الاشعاعية والنووية
رسم منحنیات معایرة الحموضة والقلویة
المؤلف:
م.مسعود فرج ابو ستة
المصدر:
تجارب في الكيمياء التحليلية (التحليل الكمي الحجمي والوزني )
الجزء والصفحة:
ص67
16-2-2016
3318
رسم منحنیات معایرة الحموضة والقلویة:
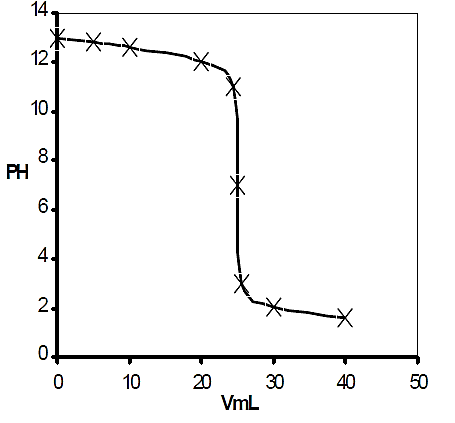
تعتبر رسم المنحنیات من الدروس العملیة المهمة جداً لما لهذه المنحنیات من أهمیة في معایرة الحموضة والقلویة فیرسم المنحنیات یمكن تحدید الدلیل المناسب لكل نوع من أنواع المعایرات وكذلك یمكن تحدید نقطة التكافؤ وأین تقع وتحدید قفزة المعایرة كل هذه الأشیاء یتم تحدیدها من خلال منحنى المعایرة ویتم رسم منحنى المعایرة برسم العلاقة بین قیمة pH وحجم الحمض أو القاعدة المضافة حیث یمثل pH على المحور العمودي والحجم على المحورالأفقي، ویعتبر عملي رسم المنحنیات من الدروس العملیة المهمة والبسیطة وخاصة في ظل وجود جهاز pH ميتر في المعامل ، وفي حالة عدم توفر الجهاز یتم حساب قیمة pH حسابیاً وذلك بعد فهم الطریقة الحسابیة من خلال دراستك للجزء النظري ویتم الرسم بتسجیل قیمة pH قبل بدایة المعایرة یعني عند0) مل من الحجم المضاف( ثم بعد ذلك یتم إضافة الحمض أو القاعدة من السحاحة بمقدار یتراوح ما بین 5 -2.5) مل (كإضافة ثابتة ، ویتم أخذ قراءة قیمة pH عقب كل إضافة وتسجل قیمة pH المقابلة لكل حجم ونستمر في هذه العملیة حتى نتعدى الحجم المأخوذ)حمض أو قلوي( الموجود في دورق المعایرة بحوالي 10مل أو أكثر تقریباً وذلك للحصول على منحنى واضح ، ولتطبیق ذلك یتم إجراء معایرة بین محلول قیاسي حمضي معلوم التركیز العیاري أو المولاري مع ومحلول قیاسي قاعدي معلوم التركیز المولاري أو العیاري و المثال التالي یوضح عملیة رسم منحنیات معایرات التعادل.
مثال
ارسم منحى معایرة 25 مل من محلول هیدروكسید الصودیوم (0.1 N ) مع حمض الهیدروكلوریك (0.1 N ) عند أضافة الحجوم التالیة ( 0,5 , 10 , 20 , 25 , 30 , 40).
الخطوة الأولى:
حساب قیمة pH قبل إضافة حمض HCl عند إضافة 0.0 مل من حمض الهیدروكلوریك. وبما أن المحلول المعایرهو قاعدة قویة فهي تفكك تفكك كاملا وعلیه یمكن حساب قیمة pOH :
pOH= -log [OH]= log(0.1) =1
ومنها یمكن حساب pH قبل أي إضافة كالأتي:
p H + p O H = 1 4
p H + 1= 1 4
p H= 1 4- 1= 1 3
الخطوة الثانیة:
عند إضافة 5 مل من حمض HCl تتعادل مع 5 مل من محلول NaOH بذلك یتبقي 20 مل من NaOHفي المحلول.
قيمة pH بعد إضافة 5 مل من HCl
یتم حساب تركیز NaOH الجدید بعد إضافة 5مل من HCl أي حساب تركیز NaOHفي 30 مل كحجم كلي.
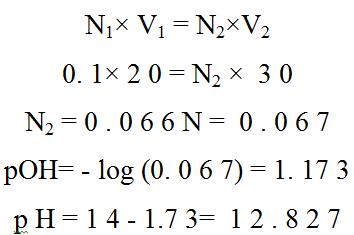
عند إضافة 5 مل من حمض HCl تتعادل مع 5 مل من محلول NaOH بذلك یتبقي 20 مل من NaOHفي المحلول.
الخطوة الثالثة:
عند إضافة 10 مل من حمض HCl تتعادل مع 10 مل من محلول NaOH بذلك یتبقي 15 مل من NaOHفي المحلول
یتم حساب تركیز NaOH في الحجم الكلى الجدید .

الخطوة الرابعة:عند إضافة 20 مل من HCl تتعادل مع 20 مل من محلول NaOH بذلك یتبقي 5 مل من NaOH في المحلول فیصبح الحجم الكلى 45 مل یتم حساب تركیز NaOH في الحجم الكلى الجدید

الخطوة الخامسة:
عند إضافة 24.5 مل من HCl تتعادل مع 24.5 مل من محلول NaOH بذلك یتبقي 0.5 مل من NaOH في المحلول فیصبح الحجم الكلى 49.5 مل .
یتم حساب تركیز NaOH في الحجم الكلى الجدید
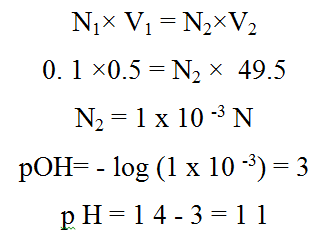
الخطوة السادسة:
عند إضافة 25 مل من HCl تتعادل مع 25 مل من محلول NaOH بذلك یتبقي 0 مل من NaOH في المحلول فیصبح الحجم الكلى 50مل عند هذه الخطوة تصبح قيمة pH = 7
الخطوة السابعة:
عند إضافة 25.5 مل من HCl فأن 0.5 مل من الحمض تتبقى في المحلول ویصبح الحجم الكلى 50.5 مل ولم یتبقى أي مل من NaOH لهذا سوف نحسب قیمة pH للمحلول التي یعبرعنها بتركیز الحمض الجدید في المحلول الكلي

لاحظ الذي حدث في هذه الخطوة السابعة عند إضافة 0.5 مل من الحمض للمحلول انخفاض قیمة pH من 7 إلى 3 وهذا سوف یكون ملاحظ من خلال المنحى.
الخطوة الثامنة :
عند إضافة 30 مل من HCl فان 5 مل من الحمض تتبقى في المحلول الكلي من غیر تعادل ویصبح الحجم الكلى 55 مل .
تركیز HCl المتبقي في المحلول

الخطوة التاسعة :
عند إضافة 40 مل من HCl فان 15 مل من الحمض تتبقى في المحلول الكلي من غیر تعادل ویصبح الحجم الكلى 65 مل .
تركیز HCl المتبقي في المحلول
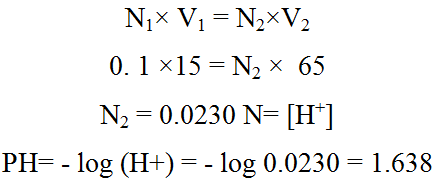
بعد نقطة التكافؤ نلاحظ تغیر طفیف في قیمة pH عقب كل إضافة من الحمض وبعد حساب قیمة pH یتم رسم المنحى بین قیمة pH وتمثل على المحور الصادي ،وحجم الحمض المضاف ویمثل على المحور السیني وبهذه الطریقة یمكن رسم منحى معایرة الحموضة و القلویة للأحماض الضعیفة و القویة والقواعد الضعیفة والقویة كما موضح في الشكل.

 الاكثر قراءة في مواضيع عامة في الكيمياء التحليلية
الاكثر قراءة في مواضيع عامة في الكيمياء التحليلية
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة

الآخبار الصحية















 قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة
قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة "المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة
"المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة (نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)
(نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)


















