

علم الكيمياء

تاريخ الكيمياء والعلماء المشاهير

التحاضير والتجارب الكيميائية

المخاطر والوقاية في الكيمياء

اخرى

مقالات متنوعة في علم الكيمياء

كيمياء عامة


الكيمياء التحليلية

مواضيع عامة في الكيمياء التحليلية

التحليل النوعي والكمي

التحليل الآلي (الطيفي)

طرق الفصل والتنقية


الكيمياء الحياتية

مواضيع عامة في الكيمياء الحياتية

الكاربوهيدرات

الاحماض الامينية والبروتينات

الانزيمات

الدهون

الاحماض النووية

الفيتامينات والمرافقات الانزيمية

الهرمونات


الكيمياء العضوية

مواضيع عامة في الكيمياء العضوية

الهايدروكاربونات

المركبات الوسطية وميكانيكيات التفاعلات العضوية

التشخيص العضوي

تجارب وتفاعلات في الكيمياء العضوية


الكيمياء الفيزيائية

مواضيع عامة في الكيمياء الفيزيائية

الكيمياء الحرارية

حركية التفاعلات الكيميائية

الكيمياء الكهربائية


الكيمياء اللاعضوية

مواضيع عامة في الكيمياء اللاعضوية

الجدول الدوري وخواص العناصر

نظريات التآصر الكيميائي

كيمياء العناصر الانتقالية ومركباتها المعقدة


مواضيع اخرى في الكيمياء

كيمياء النانو

الكيمياء السريرية

الكيمياء الطبية والدوائية

كيمياء الاغذية والنواتج الطبيعية

الكيمياء الجنائية


الكيمياء الصناعية

البترو كيمياويات

الكيمياء الخضراء

كيمياء البيئة

كيمياء البوليمرات

مواضيع عامة في الكيمياء الصناعية

الكيمياء الاشعاعية والنووية
أكسيد النتروز (أكسيد النتروجين الثنائي) (Nitrous oxide)
المؤلف:
غاري و. فان لون , ستيفن ج. دفي
المصدر:
كيمياء البيئة نظرة شاملة
الجزء والصفحة:
ص 119-121
2023-12-19
1651
من المعروف حالياً أن ثمة مصادر للـ xNO الموجود في الستراتوسفير غير المقدار الضئيل الذي يتكون في التروبوسفير أو يتولد مباشرة في الستراتوسفير. وأهم وأهم تلك المصادر هو مركّب نتروجيني آخر هو أكسيد النتروز2ON . عند ارتفاعات تقل عن 30 كيلو متراً، يمكن لأكسيد النتروز أن يتفاعل مع الأكسجين الذري المتهيج لتكوين أكسيد النتروجين وفقاً للتفاعل 17.3:

وخلافاً للـ xNO ، ليس أكسيد النتروز جذراً، ولا يمتص الضوء المرئي ويتفكك ضوئياً، ولا ينحل كثيراً في الماء. لذ يُعتبر جنساً مستقراً في التروبوسفير وتُقدَّر مدة مكوثه فيه بـ 120 سنة. ويهاجر الكثير منه إلى الستراتوسفير حيث يحصل التفاعل مع ذرات الأكسجين المتهيّجة.
يتولّد أكسيد النتروز في بيئات التربة والماء، وسوف نرى ذلك لاحقاً في الفصل الخامس عشر عندما ننظر في دورة النتروجين التي تُعتبر واحدة من أهم الدورات الطبيعية من ناحية نمو النباتات والمتعضيات الأخرى. ويتكون بواسطة سيرورة طبيعية تسمى إزالة النترتة (denitrification)، وهي سيرورة تحتاج إلى ظروف إرجاع وشوارد النترات بوصفها إحدى المتفاعلات. صحيح أن إزالة النترتة تحصل طبيعياً، إلا أن مقدار التفاعل يعتمد على توفر النترات، ولذا يتعزز في التربة التي تُزوَّد بكميات كبيرة من الأسمدة النتروجينية (الآزوتية).
ويُعتقد أن المصادر الزراعية هي أهم أسباب الزيادة البطيئة، لكن الثابتة، في نسب مزج أكسيد النتروز في التروبوسفير. لقد كان مستوى أكسيد النتروز في حقبة ما قبل الثورة الصناعية يساوي نحو pbv 275، أما نسبة المزج الحالية التي تساوي نحو ppbv 310 فهي تتزايد بمعدل يساوي ppbv 0.6 في السنة.
وثمة طريقة أخرى يتكون بها أكسيد النتروجين في الستراتوسفير، وتكتسب أهمية عند ارتفاعات تزيد على 30 كيلو متراً. عند تلك الارتفاعات، يُصبح التفكيك الكيميائي الضوئي للنتروجين الثنائي ممكناً، حيث تنتج ذرات نتروجين متهيجة إلكترونيا (N(2D وأخرى في مستوى الطاقة الدنيا ( لكن بطاقة حركية عالية ) (N(2S. ويتفاعل بعدئذ نتروجين الطاقة الدنيا مع الأكسجين الثنائي، فينتج مصدر طبيعي آخر لأكسيد النتروجين:
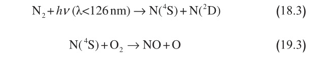
وعندما يتكون أكسيد النتروجين ، يمكن أن يُشارك في سيرورات التحفيز وفقاً للمعتاد:

ويمضي انغماس أكاسيد النتروجين في كيمياء الأوزون إلى أبعد مما جرى وصفه بواسطة دورة التحفيز يتفاعل أكسيد النتروجين أيضاً مع جذور الهدروكسيل لتكوين حمض نتروجيني:
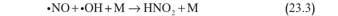
صحيح أن كلا المتفاعلين (لا الناتج) هما محفزان ممكنان لتدمير الأوزون، إلا أن يؤدي إلى تقليل تدمير الأوزون. وهذا مثال على أن مفاعيل التحفيز التي تفاعلهما معاً تتصف بها الأجناس إفرادياً ليست تضافرية دائماً.
 الاكثر قراءة في كيمياء البيئة
الاكثر قراءة في كيمياء البيئة
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة

الآخبار الصحية















 قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة
قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة "المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة
"المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة (نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)
(نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)


















