هناك عوامل متعددة تؤثر على قابلية إذابة الرواسب يمكن توضيحها بما يأتي
1- درجة الحرارة :
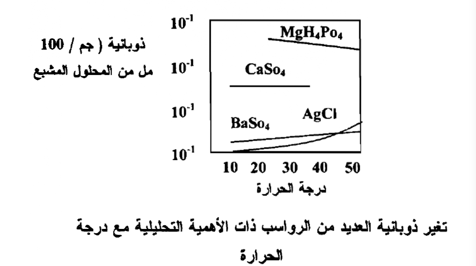
يؤدي الارتفاع في درجة الحرارة في أغلب الأحيان الي زيادة إذابة الأملاح اللاعضوية وحاصل الإذابة . فمثلاً يذوب Ksp = 1.6 x 10-5 )PbCl2 ) جزئياً عند درجة حرارة الغرفة ، ولكنه يذوب بسهولة عند درجة حرارة مرتفعة ، ويبين الشكل تأثير درجة الحرارة علي إذابة العديد من الأملاح اللاعضوية ذات الأهمية التحليلية ويمكن التنبؤ باتجاه تغيير الإذابة مع درجة الحرارة، بتطبيق مبدأ شاتليه حيث أن زيادة درجة الحرارة هي جهد ، فإن الاتزان بين الراسب وأيوناته في المحلول يختل تبعاً لذلك إذا كانت حرارة المحلول ماصة ) حيث تزداد الإذابة ) أو طاردة ( تنقص الإذابة ) :
2- طبيعة الراسب :
من المعروف أن بعض المواد أكثر ذوباناً في الماء من غيرها ويعود السبب في هذا الاختلاف الي التباين في الطاقة البلورية لكل منهما والطاقة المتضمنة في التفاعل بين المذيب وأيونات المذاب أثناء انحلال البلورات فكلما كانت محصلة الجذب بين جزيئات المذيب وأيونات المذاب أكبر من محصلة الجذب بين أيونات الملح ذاتها داخل البلورة كلما كان الملح أكثر ذوباناً .
3- حجم دقائق الراسب :
تزداد الإذابة وحاصل الإذابة للراسب كلما قل نصف قطر الدقائق أو الأنوية البلورية ويمكن تمثيل العلاقة بين قابلية إذابة الدقائق الصغيرة وأنصاف أقطارها باستخدام معادلة طومسن Thomson equation) )

حيث 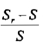 تمثل الزيادة النسبية في قابلية إذابة الدقائق ذات أنصاف أقطار r .
تمثل الزيادة النسبية في قابلية إذابة الدقائق ذات أنصاف أقطار r .
يتبين من العلاقة الأخيرة انه لراسب ما وعندما تكون a v ثابتة فإنه كلما قل نصف قطر الدقائق زادت الزيادة النسبية في قابلية الإذابة . إضافة الي هذا فإن الزيادة النسبية في قابلية الذوبان تتأثر أيضاً بالشد السطحي للصلب فكلما كان الشد السطحي كبيراً كانت الزيادة النسبية في قابلية الإذابة كبيرة وسيؤدي ذلك الي نمو الدقائق الكبيرة علي حساب الدقائق الصغيرة وينتج راسب بلوري ذو أشكال هندسية منتظمة والعكس صحيح .
4- تأثير المذيب :
تتأثر إذابة المركبات الأيونية في المذيبات بعاملين هما قطبية المذيب وثابت العزل الكهربائي ( Dielectric Constant ) فكلما كان المذيب أكثر قطبية ازداد الجذب بينه وبين أيونات الملح وارتفعت الإذابة ولهذا فإن الماء هو مذيب جيد لكثير من الأملاح الأيونية لأن له قطبية عالية وثابت عزل كهربائي عال ولكنه مذيب ضعيف للمركبات اللاقطبية في حين أن المذيبات اللاقطبية مثل البنزين ورابع كلوريد الكربون تكون وسطاً جيداً لذوبان المواد اللاقطبية . وتقل قابلية ذوبان المركبات اللاعضوية عادة في الماء بإضافة المذيبات العضوية مثل الكحول والأسيتون ويمكن الاستفادة من هذه الظاهرة لفصل مادتين ذائبتين في الماء عن بعضهما . فمثلاً يمكن فصل مزيج جاف من نترات الكالسيوم ونترات السترنتيوم وذلك بمعاملتهما مع مزيج من الكحول والأيثير حيث تذوب نترات الكالسيوم تاركة نترات السترنتيوم كذلك يمكن فصل البوتاسيوم عن الصوديوم عن طريق ترسيب البوتاسيوم علي شكل KPtCls من مزيج مكون من الماء والكحول .
5- تأثير الأيون المشترك :
تكون إذابة الراسب بصورة عامة في الماء أكثر من ذوبانيته في محلول يحتوي على أحد أيونات الراسب فمثلاً في محلول كلوريد الفضة في الماء فإن حاصل ضرب تركيزات أبونات الفضة والكلوريد لا يمكن أن تزداد عن قيمة ثابت حاصل الإذابة 10- 10 x 1 . ويكون تركيز كل أيون في الماء هو x 10 -5 M 1. لكن عند إضافة كمية كافية من نترات الفضة وذلك لجعل تركيز أيونات الفضة 4- 10 1 x فإن تركيز أيونات الكلوريد يجب أن يقل الي قيمة 6- 10 1 x وأن التفاعل :
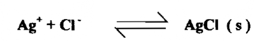
يرغم على التوجه الى اليمين من قبل الزيادة من أيونات الفضة مما يسبب ترسيب زيادة من الملح وخفض كمية الكلوريد الباقية في المحلول ويمكن الاستفادة من تأثير الأيون المشترك من أجل الحصول على ترسيب كامل في التحليل الوزني .
مثال 14 :
احسب الإذابة المولارية الفلوريد الكالسيوم ( حاصل الإذابة 11- 10 4 x )
أ - في الماء .
ب - في محلول كلوريد الكالسيوم تركيزه M0.01
جـ - في محلول فلوريد الصوديوم تركيزه M0.01


6- تأثير الأس الهيدروجيني على الذوبان :
يعتمد ذوبان أملاح الأحماض الضعيفة علي الأس الهيدروجيني للمحلول ومسن بين الأمثلة المهمة لهذه الأملاح في الكيمياء التحليلية هي الأوكزالات والكبريتيدات والهيدروكسيدات والكاربونات والفوسفات حيث يتحد أيون الهيدرونيوم مع أيون الملح السالب ليكون حامضاً ضعيفاً وتزداد إذابة الملح ، مثال على ذلك هو راســــب فلوريــــد الكالسيوم الذي يحتوي علي أيون الفلوريد السالب والذي يميل الي الإتحاد مع أيـــون الهيدرونيوم لإعطاء فلوريد الهيدروجين وتزداد إذابة فلوريد الكالسيوم مع الزيادة في الحامضية
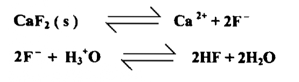
وفي حالة المحاليل المعتدلة الحامضية فإن تركيز أيون الهيدروجين سوف لا يتغير بصورة واضحة عندما يبدأ الملح بالذوبان نفترض أولاً الحالة البسيطة ، ملح MA لحامض ضعيف HA حيث يمكن أن يمثل الاتزان كما يلي :


حيث أن Keff تمثل ثابت حاصل الإذابة المؤثر
( effective solubility product constant ) وتتغير قيمة Keff مع الأس الهيدروجيني وذلك لأن pH تعتمد على 1 α
وبالنسبة لملح MA2 فإن العلاقة تكون :
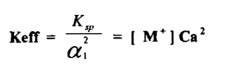
ولحامض ثنائي البروتون A2- H2A ( diprotic acid ) فإن التركيز يمكن أن يعطي بـ α2 Ca حيث أن
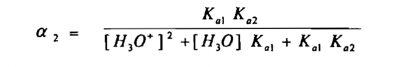
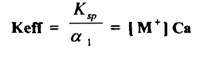
مثال 15 :
احسب الإذابة المولارية لـ CaF2 في محلول حامض الهيدروكلوريك ذو دالة هيدروجينية تساوي 3 مع العلم أن Ksp لفلوريد الكالسيوم هي -11 10 4 X وإن Ka هو الحامض فلوريد الهيدروجين HFهو 6x10-4
الحل :

مثال 16:
احسب إذابة CaC2O4 في محلول HCI ذي أس هيدروجيني يساوي 3 مع العلم أن Ksp لأوكزالات الكالسيوم 2x10 -9 وان
Ka1 = 6.5 × 10 - 2
×10-5Ka2=6.1
الحل :

يعتمد فصل كبريتيدات المعادن على السيطرة على الأس الهيدروجيني للمحلول حيث أن المعادن التي تكون كبريتيدات ذات إذابة قليلة ( المجموعة ( II تترسب باستخدام H2S
وبوجود M0.1 من حامض الهيدروكلوريك . ترفع الأس الهيدروجيني لترسيب معادن المجموعة. ( III ) يعد كبريتيد الهيدروجين H2S حامض ثنائي البروتون ويطبق الرمز2α اعلاه على أي حالة وحيث أن ثوابت الحامض Ka2, Ka1
قليلين x 1 و 1 Ka و2 Ka = -5 10 و Ka1 x 10-7 1 فإن قيم Ka1 و2Ka
1 Ka H3O +] [ في مقام المعادلة السابقة يمكن إهمالها بالمقارنة مع قيمة 2 H3O+ ] [ ولهذا فإن قيمة 2 a تساوي
تساوي
إضافة الى هذا فإنه في المحاليل الحامضية القوية فإن التركيز التحليل الهيدروجين يساوي تقريباً
C1 = [H2S] + [HS ́] + [ S2 ̄ ] ≈ [ H2S]
حيث أن تركيز أيون الكبريتيد α C2 يصبح
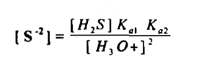
وحيث أن المحلول المشبع بكبريتيد الهيدروجين تركيزه يقارب منM0.1 لهذا فإن
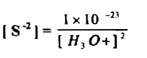
وتبين المعادلة الأخيرة أن تركيز أيون الكبريتيد يتغير مع تركيز أيون الهيدروجين .
مثال 17 :
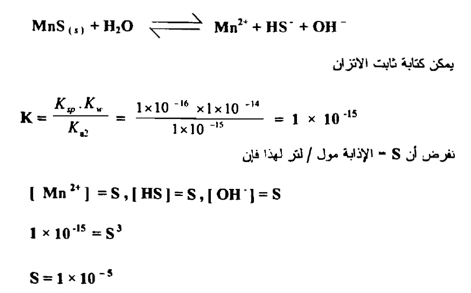
شبع محلول 100 سم3 نو تركيز M 0.1 من كل من Ca+2 و و Mn+2 0.20 M من [O+3 [H
أولاً : اثبت أي من كبريتيد المعدن يترسب أولاً مع العلم أن Ksp للـ CuS هي -16 10 4x وللـ MnS 1 x 10 - 16
ثانياً : ما تركيز أيون الهيدروجين الذي عنده يبدأ راسب كبريتيد المنجنيز بالترسيب .
تركيز أيون الكبريتيد اللازم حتى يكون [ S2- ] [ +2 Ksp = [ Mn
الحل :

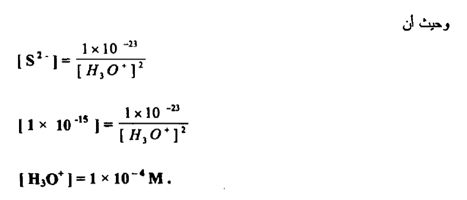
مثال 18:
احسب الأس الهيدروجيني الذي تبدأ الهيدروكسيدات الآتية بالترسيب في محلول يحتوي على M0.1 من كل مكن الأيون الموجب مع العلم أن Ksp لهيدروكسيد الحديديك Fe (OH)3هو-36 10X 1 ولهيدروكسيد المغنسيوم Mg = ( OH)2 هو1 x 10-11
الحل :

- 7 تأثير التحلل المائي :
الأيون السالب للملح MA يتحلل مائياً كلياً كما يلي :
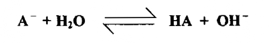
يكون هذا تقريباً جيداً إذا كان HA هو حامض ضعيف جداً وأن MA لا تذوب بصورة جيدة ( هذا يعني أن كلاً من Ka و .Ksp قليلة ) . يلاحظ انه كلما كان تركيز A- قليلاً ، كان التحلل المائي أكثر اكتمالاً.
ويمكن وضع افتراضين يعتمدان على قيمة Ksp :
أ- إذا كانت الإذابة قليلة جداً فإنه لا يتغير الأس الهيدروجيني بصورة ملحوظة نتيجة التحلل المائي .
ب- إذا كانت الإذابة كبيرة بصورة كافية فإن تركيز أيونات الهيدروكسيل الناتجة عن الماء يمكن إهمالها .
مثال 19 :
احسب الإذابة المولارية في الماء (أ) CuS له Ksp- 10-38 X4 و (ب) MnS له Ksp x10-16 1بافتراض تفاعل التحلل المائي التالي :
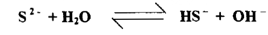
الحل :
أ - وحيث أن الإذابة للـ CuS قليلة جداً فإنه يمكن إهمال OH- الناتجة عن التحلل المائي وبأخذ 1 x 10-7 - [ OH ] فإنه

ب – وحيث أن التحلل المائي كاملاً فإنه يمكن كتابة التفاعل كما يلي
ويمكن أن يعاني الأيون الموجب للملح تحللاً مائياً كما هو الحال في الأيونات السالبة وهذا يسبب زيادة في الإذابة أيضاً ويمكن تمثيل التحلل المائي النموذجي
للحديد( III ) كما يلي : -
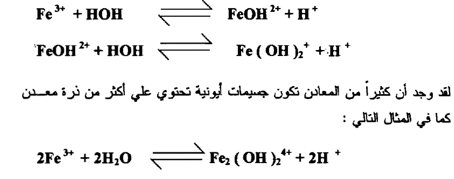
8- تأثيرات المعقدات :
تعتمد إذابة الأملاح الشحيحة الذوبان أيضاً علي تركيز المواد التي تكون معقدات الأيونات الموجبة للملح ، وبعد تأثير التحلل المائي الذي شرح سابقاً أحد الأمثلة التي فيها كاشف المعقدات هو أيون الهيدروكسيل وتعتبر كواشف المعقدات عــادة جزيئات متعادلة وأيونات سالبة وتكون مشتركة أو غريبة عن الراسب . إن أحد الأمثلة الشائعة والجيدة في الكيمياء التحليلية هو تأثير الأمونيا علي إذابة هاليدات الفضة وخاصة كلوريد الفضة . يذوب كلوريد الفضة في الأمونيا ويمكن استخدام هذه الحقيقة في فصل الفضة عن الزئبق في المجموعة الأولي في التحليل الوصفي وتكون الفضة معقدين مع الأمونيا :

مثال 20 :
احسب الإذابة المولارية للـ AgCl في M0.01 من الأمونيا ( يمثل هذا التركيز النهائي لجزيئات الأمونيا الحرة في المحلول ( مع العلم أن له Ksp = -10 1.0 x 10
لـ AgCI و وثابت الإتزان K1 = 103 x 2.3 و K2= x 103 .0.6
الحل :
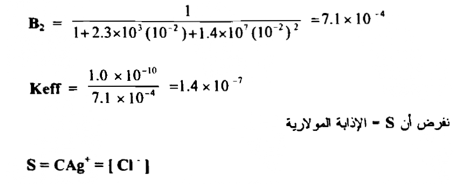
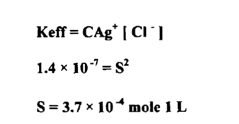
 الاكثر قراءة في مواضيع عامة في الكيمياء التحليلية
الاكثر قراءة في مواضيع عامة في الكيمياء التحليلية
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة


