

علم الكيمياء

تاريخ الكيمياء والعلماء المشاهير

التحاضير والتجارب الكيميائية

المخاطر والوقاية في الكيمياء

اخرى

مقالات متنوعة في علم الكيمياء

كيمياء عامة


الكيمياء التحليلية

مواضيع عامة في الكيمياء التحليلية

التحليل النوعي والكمي

التحليل الآلي (الطيفي)

طرق الفصل والتنقية


الكيمياء الحياتية

مواضيع عامة في الكيمياء الحياتية

الكاربوهيدرات

الاحماض الامينية والبروتينات

الانزيمات

الدهون

الاحماض النووية

الفيتامينات والمرافقات الانزيمية

الهرمونات


الكيمياء العضوية

مواضيع عامة في الكيمياء العضوية

الهايدروكاربونات

المركبات الوسطية وميكانيكيات التفاعلات العضوية

التشخيص العضوي

تجارب وتفاعلات في الكيمياء العضوية


الكيمياء الفيزيائية

مواضيع عامة في الكيمياء الفيزيائية

الكيمياء الحرارية

حركية التفاعلات الكيميائية

الكيمياء الكهربائية


الكيمياء اللاعضوية

مواضيع عامة في الكيمياء اللاعضوية

الجدول الدوري وخواص العناصر

نظريات التآصر الكيميائي

كيمياء العناصر الانتقالية ومركباتها المعقدة


مواضيع اخرى في الكيمياء

كيمياء النانو

الكيمياء السريرية

الكيمياء الطبية والدوائية

كيمياء الاغذية والنواتج الطبيعية

الكيمياء الجنائية


الكيمياء الصناعية

البترو كيمياويات

الكيمياء الخضراء

كيمياء البيئة

كيمياء البوليمرات

مواضيع عامة في الكيمياء الصناعية

الكيمياء الاشعاعية والنووية
تفاعلات الإضافة إلى الألكينات
المؤلف:
أ. د محمد مجدي واصل
المصدر:
اساسيات الكيمياء العضوية
الجزء والصفحة:
ص 224 -225-226-227-228-229-230-231-232-233
2023-08-13
8733
1- هدرجة الألكينات ( الاختزال ) :
يؤدي تفاعل الألكينات مع الهيدروجين في وجود كمية صغيرة من عامل حفاز مثل النيكل أو البلاتينيوم أو البلاديوم ؛ على هيئة مسحوق ناعم إلى تكوين الكان . وتفاعل الإضافة هذا ( الهدرجة المحفزة ) يشمل إضافة ذرة هيدروجين لكل ذرة كربون مزدوجة كما يلي :
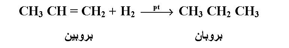
وتفاعلات الهدرجة طاردة للحرارة حيث تبلغ القيمة الوسطى لحرارة الهدرجة لرابطة كربون - كربون مزدوجة في حدود 30 كيلو سعر / مول .
2- إضافة الهالوجبنات :
تتفاعل الألكينات بالإضافة مع الكلور أو البروم عند درجة حرارة عادية وفي مذيب رباعي كلوريد الميثان لتعطي مشتقات ثنائية الهالوجين كما يلي :
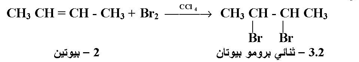
ولا يتفاعل اليود مع الألكينات لقلة فاعليته كما يستخدم تفاعل البروم مع الألكينات للكشف عن وجود الرابطة المزدوجة في المركبات العضوية .
فلون المحلول (Br2 / CCl4 ) أحمر برتقالي لكنه يزول إذا أضيف إلى كمية كافية من الألكين وتضاف ذرتا الهالوجين ( البروم ) إلى الألكين من جانبين مختلفين بطريقة متعاقبة .
3- إضافة الأحماض الهالوجينية :
تكون إضافة الأحماض الهالوجينية أو هاليدات الهيدروجين للألكينات ذات طبيعة أيونية وتبدأً بهجوم الكتروفيلي للكشف الموجب من الكاشف المتفاعل وهو ما يسمى بالكاشف الألكتروفيلي على الكترونات الرابطة المزدوجة .
ويؤدي هذا إلى تكوين رابطة تساهمية مستخدمة الكتروني الرابطة المزدوجة لينشاً كيان وسيط يسمى كاتيون كربوني (Carbonium) أو أيون كربونيوم
( Carbonium ) الذي بدوره يتحد مع الشق السالب للكاشف .
ويمكن إضافة هاليدات الهيدروجين مثل HF , HCl ,HBr , HI بسهولة للألكينات ويتم ذلك أما بإذابة هاليدات الهيدروجين في مذيب معين ثم يخلط مع الألكين أو بإمرار هاليد الهيدروجين الغازي في الألكين بطريقة مباشرة .
ويعتبر يوديد الهيدروجين من أكثر هاليدات الهيدروجين فعالية ويليه بروميد الهيدروجين ثم كلوريد الهيدروجين . ويعود ذلك إلى أن الرابطة
بين الهالوجين - الهيدروجين تضعف تنازليا ابتداء من الفلور وانتهاء باليود .
وعند إضافة HX إلى ألكين متماثل مثل أيثين فذلك لا يمثل أي مشكلة حيث يتكون ناتجاً واحداً بغض النظر عن ذرة الكربون التي أضيف إليها البروتون والأخرى التي أضيف إليها الشق السالب -( X) :

لكن عند إضافة كاشف الكتروفيلي غير متماثل مثل (HCl) إلى ألكين غير متماثل ( مثل بروبين ) فإن الإضافة يمكن أن تتم كما يلي :
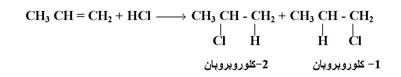
لكن النتائج العملية بينت أن ناتجاً واحداً فقط هو الذي يتكون وهو 2- كلوروبروبان كذلك فعند إضافة HI إلى 2- ميثيل بروبين يكون الناتج الوحيد 2- يودو -2- ميثيل بروبان :

وقد لوحضت ظاهرة إضافة الكواشف غير المتماثلة إلى الألكينات غير المتمائلة ؛ حيث توصل ماركينوكوف إلقاعدة تعرف باسمه " قاعدة ماركينوكوف " تساعدنا على التنبؤ بنواتج إضافة الكواشف الالكتروفيلية غير المتماثئلة إلى الألكينات غير المتماثلة .
قاعدة ماركينوكوف :
تنص هذه القاعدة على أنه عند إضافة كاشف الكتروفيلي غير متماثل ( مثل HX ) لألكين غير متماثل ( مثل بروبين ) فإن أيون الهيدروجين ( الشق الموجب ) يتحد مع ذرة كربون الرابطة المزدوجة التي تمتلك أكبر عدد من الهيدروجين ؛ ويتحد الشق السالب ( مثل X- ) بذرة كربون الرابطة المزدوجة التي تحمل العدد الأقل من ذرات الهيدروجين .

أي أن التفاعل يبدا بهجوم الالكتروفيلي تقوم به ذرة لا يوجد بها إلكترونات مثل البروتون ويستكمل التفاعل بإضافة نيوكليوفيل أي ذرة أو مجموعة غنية بالألكترونات مثل أيون الكلوريد . أما التفسير النظري لقاعدة ماركينوكوف فيمكن تبسيطه مما يلي :
أ- يجب إن تؤدي إضافة (HX ) إلى ألكين غير متماثل إلى تكوين كربوكاتيون ذو ثبات أكثر . أي تكون طاقة النتشيط أقل وبالتالي يتكون الوسيط بسرعة ويؤدي إلى الناتج الأكثر استقراراً .
ب- حيث أن طاقة التنشيط للكربوكاتيونات الثنائية أقل من الكربوكاتيونات الأولية فإن عدد الإصطدامات المؤثرة التي تعبر حاجز الحالة الانتقالية في الحالة الأولى تكون أكثر وبالتالي يكون الناتج لها أسرع تكوناً وأكثر ثباتاً .
2- إضافة برومبد الهيدروجين :
تتفاعل الألكينات مع برميد الهيدروجين بعكس قاعدة ماركينوكوف أي كما يلي :
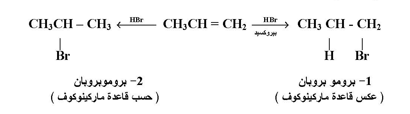
وهذه الظاهرة لا توجد إلا في حالة بروميد الهيدروجين الذي يتأثر لتأثير البروكسيدات . أما بقية الأحماض الهالوجينية الأخرى فلا تظهر عليها مثل هذه الظاهرة . وميكانيكية أو آلية تفاعل إضافة HBr إلى الألكينات في وجود بيروكسيد يتبع ميكانيكية الشقوق الطليقة أو الجذور الحرة .
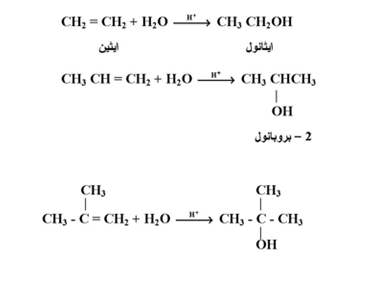
3- إضافة الماء :
تضاف عناصر الماء إلى الرابطة المزدوجة في الألكينات بوجود كمية حفزية من حمض الكبريتيك المركز أو حمض الفوسفوريك لتعطي كحولات ثانوية أو ثلثية وتتبع الإضافة قاعدة ماركينوكوف :
4- إضافة حمض الكبربتيك المركز :
تتفاعل الألكينات مع حمض الكبريتيك المركز البارد وتذوب فيه » ويرتبط بروتون الحمض بإحدى ذرتي كربون الرابطة المزدوجة ويتحد الشق السالب بذرة الكربون الأخرى حسب قاعدة ماركينوكوف لتعطي نواتج تعرف بكبريتات الألكيل الهيدروجينية :
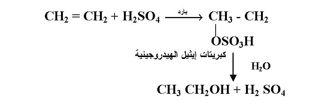
وتعتبر كبريتات ألكيل الهيدروجينية مركبات غير ثابتة سرعان ما تتمياً بواسطة الماء لتعطي كحول كناتج نهائي .
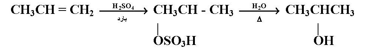
5- أكسدة الألكينات :
يمكن للألكينات أن تتأكسد في الأكسجين أو الهواء ليتكون غاز ثاني أكسيد الكربون وماء وحرارة .

ومن الكواشف المؤكسدة والمستخدمة نجد بيرمنجنات البوتاسيوم ورباعي أكسيد الأوزميوم والأحماض البيروكسية والأوزون أو مخلوط من فوق أكسيد الهيدروجين وحمض الخليك . ويعتمد الناتج على ظروف التفاعل الذي يعتبر في جوهره تفاعل إضافة . وقد يتوقف التفاعل عند حد الإضافة أو قد يستمر ليؤدي إلى انشطار الرابطة المزدوجة .
أ- الأكسدة بالببرمنجنات :
يستخدم محلول متعادل بيرمنجات البوتاسيوم البارد أو المخفف ليحول الألكين إلى جليكول .

ويتضح أن الإضافة تتم من جانب واحد للألكين وتستخدم البيرمنجنات في الكشف على وجود ألكين حيث يزول لون البيرمنجنات البنفسجي ويتكون
راسب بني ( Mno2) .
ب- ببرمنجنات البوتاسبوم المركزة والساخنة :
يؤدي تأكسد الألكينات عند ظروف شديدة وباستخدام محلول بيرمنجنات البوتاسيوم المركزة الحمضية وعند درجة حرارة مرتفعة إلى انشطار الرابطة المزدوجة ويكون الناتج تبعاً لظروف التفاعل وبنية الألكين :
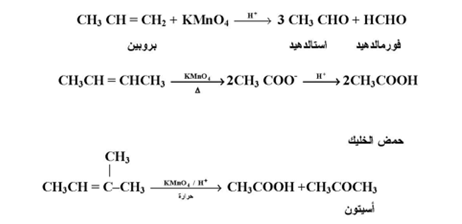
ويستفاد من هذا التفاعل للتعرف على بناء ألكين معين بتحديد نوعية الناتج . وفي حالة وجود رابطة مزدوجة طرفية مثل 1 - ألكين فإنها تتأكسد إلى CO2 أما ذرتي كربون الرابطة المزدوجة ذات التفرع الثنائي فإنها تتحول إلى كيتون :
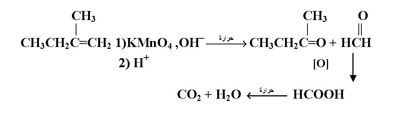
ويستخدم مثل هذا التفاعل لتحديد موقع الرابطة المزدوجة في الألكينات .
ج - إضافة الأكسجين :
يضاف الأكسجين في وجود فلز الفضة إلى الرابطة المزدوجة في الألكينات مكوناً ما يعرف بالايبوكسيدات :
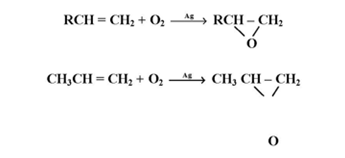
د- الأكسدة بالأوزن :
يتفاعل الأوزون بقوة مع الألكينات ليعطي ناتج إضافة يسمىر أوزونيد وهذه مركبات غير ثابتة لذا فإنها عادة لا تفصل بل تختزل مباشرة بمعالجتها بمسحوق الخارصين والماء لتنتتج مركبات كربونية ( الدهيدات وكيتونات ) :
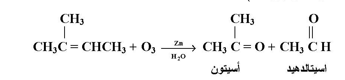
ويعتبر تفاعل الأوزنة طريقة ممتازة لتعيين وتحديد موقع الرابطة المزدوجة في الألكينات وذلك بدراسة بنية الألدهيدات والكيتونات المتكونة وبالتالي يساعد إلى الوصول إلى بناء الألكين الأصل .
فمثلاً عند معالجة ألكين معين بالأوزون ومن ثم بالخارصين والماء تكونت الدهيدات ولذا نستنتج أن الألكين CH3 CH2, CHO , CH3 CHO الأصل هو 2 - بنتين CH3, CH2, CH=CH CH3 .
6- إضافة أحماض الهيبوهالوز :
تضاف أحماض الهييوهالوز ( هالوجين في محلول مائي HOX ) إلى الألكينات يكون الناتج
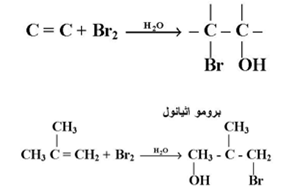
ويتضح من الأمثلة أن الإضافة تتم على جانبي الألكين كما أنه عند وجود الألكين غير متمائل فإن ذرة الهالوجين تتصل بذرة الكربون التي تحمل العدد الأكبر من ذرات الهيدروجين في الألكين.
7- تأثير الحرارة :
عند تسخين ألكني بوجود عامل مساعد ؛ فإن موقع الرابطة الزوجة يتغير ليعطي ألكيناً أكثر ثباتاً .
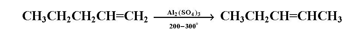
البلمرة :
تعتبر بلمرة الألكينات من التفاعلات المهمة صناعياً . وتعني بالبلمرة بناء أو تجمع وحدات أو جزيئات صغيرة تعرف بالمونمرات ( Monomes ) لتتحول إلى مركبات كبيرة لها أوزان جزيئية عالية تسمى البواليمرات (Polymers) .
 الاكثر قراءة في الهايدروكاربونات
الاكثر قراءة في الهايدروكاربونات
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة

الآخبار الصحية















 قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة
قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة "المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة
"المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة (نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)
(نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)


















