

علم الكيمياء

تاريخ الكيمياء والعلماء المشاهير

التحاضير والتجارب الكيميائية

المخاطر والوقاية في الكيمياء

اخرى

مقالات متنوعة في علم الكيمياء

كيمياء عامة


الكيمياء التحليلية

مواضيع عامة في الكيمياء التحليلية

التحليل النوعي والكمي

التحليل الآلي (الطيفي)

طرق الفصل والتنقية


الكيمياء الحياتية

مواضيع عامة في الكيمياء الحياتية

الكاربوهيدرات

الاحماض الامينية والبروتينات

الانزيمات

الدهون

الاحماض النووية

الفيتامينات والمرافقات الانزيمية

الهرمونات


الكيمياء العضوية

مواضيع عامة في الكيمياء العضوية

الهايدروكاربونات

المركبات الوسطية وميكانيكيات التفاعلات العضوية

التشخيص العضوي

تجارب وتفاعلات في الكيمياء العضوية


الكيمياء الفيزيائية

مواضيع عامة في الكيمياء الفيزيائية

الكيمياء الحرارية

حركية التفاعلات الكيميائية

الكيمياء الكهربائية


الكيمياء اللاعضوية

مواضيع عامة في الكيمياء اللاعضوية

الجدول الدوري وخواص العناصر

نظريات التآصر الكيميائي

كيمياء العناصر الانتقالية ومركباتها المعقدة


مواضيع اخرى في الكيمياء

كيمياء النانو

الكيمياء السريرية

الكيمياء الطبية والدوائية

كيمياء الاغذية والنواتج الطبيعية

الكيمياء الجنائية


الكيمياء الصناعية

البترو كيمياويات

الكيمياء الخضراء

كيمياء البيئة

كيمياء البوليمرات

مواضيع عامة في الكيمياء الصناعية

الكيمياء الاشعاعية والنووية
Kinetics
المؤلف:
Charge DistributionWilliam Reusch
المصدر:
Virtual Textbook of Organic Chemistry
الجزء والصفحة:
............
28-7-2018
1561
Kinetics
One way of investigating the molecularity of a given reaction is to measure changes in the rate at which products are formed or reactants are lost, as reactant concentrations are varied in a systematic fashion. This sort of study is called kinetics, and the goal is to write an equation that correlates the observed results. Such an equation is termed a kinetic expression, and for a reaction of the type: A + B –––> C + D it takes the form: Reaction Rate = k[A] n[B] m, where the rate constant k is a proportionality constant that reflects the nature of the reaction, [A] is the concentration of reactant A, [B] is the concentration of reactant B, and n & m are exponential numbers used to fit the rate equation to the experimental data. Chemists refer to the sum n + m as the kinetic order of a reaction. In a simple bimolecular reaction n & m would both be 1, and the reaction would be termed second order, supporting a mechanism in which a molecule of reactant A and one of B are incorporated in the transition state of the rate-determining step. A bimolecular reaction in which two molecules of reactant A (and no B) are present in the transition state would be expected to give a kinetic equation in which n=2 and m=0 (also second order). The kinetic expressions found for the reactions shown at the beginning of this section are written in blue in the following equations. Each different reaction has its own distinct rate constant, k#. All the reactions save 7 display second order kinetics, reaction 7 is first order.
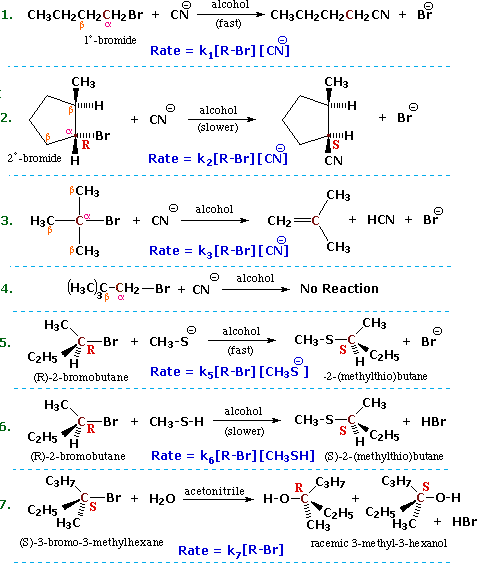
It should be recognized and remembered that the molecularity of a reaction is a theoretical term referring to a specific mechanism. On the other hand, the kinetic order of a reaction is an experimentally derived number. In ideal situations these two should be the same, and in most of the above reactions this is so. Reaction 7 above is clearly different from the other cases reported here. It not only shows first order kinetics (only the alkyl halide concentration influences the rate), but the chiral 3º-alkyl bromide reactant undergoes substitution by the modest nucleophile water with extensive racemization. Note that the acetonitrile cosolvent does not function as a nucleophile. It serves only to provide a homogeneous solution, since the alkyl halide is relatively insoluble in pure water.
One of the challenges faced by early workers in this field was to explain these and other differences in a rational manner.
 الاكثر قراءة في مواضيع عامة في الكيمياء العضوية
الاكثر قراءة في مواضيع عامة في الكيمياء العضوية
 اخر الاخبار
اخر الاخبار
اخبار العتبة العباسية المقدسة

الآخبار الصحية















 قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة
قسم الشؤون الفكرية يصدر كتاباً يوثق تاريخ السدانة في العتبة العباسية المقدسة "المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة
"المهمة".. إصدار قصصي يوثّق القصص الفائزة في مسابقة فتوى الدفاع المقدسة للقصة القصيرة (نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)
(نوافذ).. إصدار أدبي يوثق القصص الفائزة في مسابقة الإمام العسكري (عليه السلام)


















