
تاريخ الفيزياء

علماء الفيزياء


الفيزياء الكلاسيكية

الميكانيك

الديناميكا الحرارية


الكهربائية والمغناطيسية

الكهربائية

المغناطيسية

الكهرومغناطيسية


علم البصريات

تاريخ علم البصريات

الضوء

مواضيع عامة في علم البصريات

الصوت


الفيزياء الحديثة


النظرية النسبية

النظرية النسبية الخاصة

النظرية النسبية العامة

مواضيع عامة في النظرية النسبية

ميكانيكا الكم

الفيزياء الذرية

الفيزياء الجزيئية


الفيزياء النووية

مواضيع عامة في الفيزياء النووية

النشاط الاشعاعي


فيزياء الحالة الصلبة

الموصلات

أشباه الموصلات

العوازل

مواضيع عامة في الفيزياء الصلبة

فيزياء الجوامد


الليزر

أنواع الليزر

بعض تطبيقات الليزر

مواضيع عامة في الليزر


علم الفلك

تاريخ وعلماء علم الفلك

الثقوب السوداء


المجموعة الشمسية

الشمس

كوكب عطارد

كوكب الزهرة

كوكب الأرض

كوكب المريخ

كوكب المشتري

كوكب زحل

كوكب أورانوس

كوكب نبتون

كوكب بلوتو

القمر

كواكب ومواضيع اخرى

مواضيع عامة في علم الفلك

النجوم

البلازما

الألكترونيات

خواص المادة


الطاقة البديلة

الطاقة الشمسية

مواضيع عامة في الطاقة البديلة

المد والجزر

فيزياء الجسيمات


الفيزياء والعلوم الأخرى

الفيزياء الكيميائية

الفيزياء الرياضية

الفيزياء الحيوية

الفيزياء العامة


مواضيع عامة في الفيزياء

تجارب فيزيائية

مصطلحات وتعاريف فيزيائية

وحدات القياس الفيزيائية

طرائف الفيزياء

مواضيع اخرى
القانون الثاني للديناميكا الحرارية
المؤلف:
بيتر أتكينز
المصدر:
الكيمياء الفيزيائية
الجزء والصفحة:
ص 34 – ص 36
2024-10-01
972
يُعد القانون الثاني للديناميكا الحرارية قانونًا أساسيًا تمامًا لتطبيق الديناميكا الحرارية في مجال الكيمياء، والذي عادةً ما يتخذ شكلا متخفيًا، ولكن دائمًا ما يكون قابعا وراء النقاشات الدائرة حول التفاعلات الكيميائية وتطبيقاتها في علم الأحياء والتكنولوجيا على حد سواء.
يعين القانون الأول حدود التغيرات المحتملة (فهي يجب أن تحافظ على إجمالي كمية الطاقة، ولكن تتيح لها الانتقال من مكان إلى آخر أو التحول إلى حرارة أو شغل). ومن بين تلك التغيرات المحتملة يحدد القانون الثاني التغيرات التي قد تحدث بشكل تلقائي. والمعنى الاعتيادي لـ «التلقائية» هو أنها تحدث «بدون وساطة خارجية»؛ وهذا يعني في الكيمياء الفيزيائية، بدون الاضطرار إلى بذل «شغل» لإحداث التغير. وهذا لا يعني السرعة، كما تعني الكلمة ضمنًا أحيانًا في إطار الكلام العادي. قد تكون التغيرات التلقائية بطيئة جدا: فالاسم يشير ببساطة إلى أن بها «نزعة» لأن تحدث بدون تدخل. ومن منطلق هذا المعنى، يُعد تحول الألماس إلى جرافيت أمرًا تلقائيًّا؛ إلا أنه يحدث ببطء شديد لدرجة أنه يمكن التغاضي عن التغير من الناحية العملية. فتمدد الغاز في فراغ هو عملية تلقائية وسريعة على حد سواء. أما انضغاطه إلى حجم أصغر فهو عملية غير تلقائية: يجب علينا أن نبذل شغلًا ونضغط على مكبس ما لإحداث هذا التغير. باختصار، يحدد القانون الأول التغيرات المحتملة؛ ويحدد القانون الثاني أي هذه التغيرات المحتملة هي تغيرات تلقائية. يحدد القانون الثاني التغيرات التلقائية باعتبارها تغيرات تصاحبها زيادة في الإنتروبي. والإنتروبي، الذي يُرمز له بـ S، هو مقياس لجودة الطاقة: فالإنتروبي القليل يعني مستوى عاليًا من الجودة بمعنى سأشرحه؛ أما الإنتروبي العالي، فيعني مستوى متدنيًا من الجودة والمقابل الإنجليزي لمصطلح إنتروبي entropy مشتق من العبارة اليونانية التي تعني «التحول إلى الداخل»، وتعطي انطباعًا بالتغيرات التي تحدث داخل نظام ما. ومن ثم، فإن الزيادة في الإنتروبي توازي الانخفاض في جودة الطاقة، فهي مثلا تتبدد على نطاق أوسع وتقل فائدتها في بذل الشغل.
والإنتروبي مرتبط عادةً بقياس الفوضى أو الاضطراب، مثل تبدد الطاقة أو انتشار غاز ما (انظر شكل 2–2). وهذا تفسير مفيد جدًّا يجب وضعه في الاعتبار. كان أول من اقترح التعبير الكمي لحساب القيمة العددية للتغير في الإنتروبي هو الفيزيائي الألماني رودولف كلاوزيوس (1822–1888) في عام 1854: تقتضي صيغته أنه من أجل حساب التغير في الإنتروبي يجب علينا أن نلاحظ بدقة الطاقة التي تنتقل كحرارة أثناء التغير ونقسمها على درجة الحرارة المطلقة التي يحدث عندها التغير. وبالتالي، إذا أُدخل 100 جول من الحرارة إلى دورق من الماء عند درجة حرارة 20 درجة مئوية (293 كلفن)، يزداد إنتروبي الماء بمقدار 0.34 جول لكل كلفن. وقد طور نهج مختلف جدا ولكنه تكميلي وثاقب بصورة بالغة على يد لودفيج بولتزمان.
لقد استعان علماء الكيمياء الفيزيائية بصيغة كلاوزيوس لتجميع جداول قيم الإنتروبي الخاصة بمجموعة كبيرة من المواد (حيث استعانوا أيضًا بالقانون الثالث للديناميكا الحرارية، والتي يمكن الاستعانة بها لتقييم التغير في الإنتروبي عندما تتغير المواد المتفاعلة ذات إنتروبي معين إلى نواتج ذات إنتروبي مختلف.
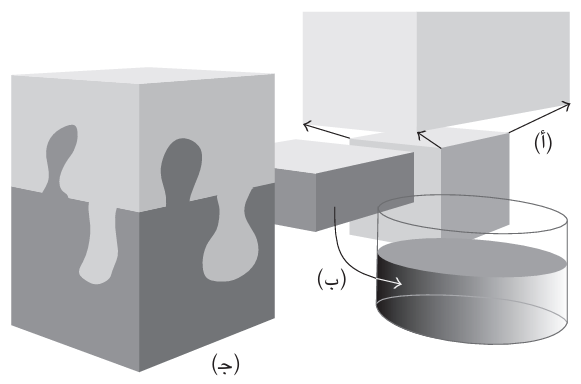
شكل 2–2: الإنتروبي هو مقياس لـ «الاضطراب». ومن ثَم، فهي تزداد (أ) عندما ينتشر غاز ما، و (ب) عندما تنصهر مادة صلبة ، و (ج) عندما تختلط مادتان.
وهذه معلومة ضرورية لتقرير ما إذا كان التفاعل تلقائيا عند أية درجة حرارة معينة (تذكر أنه ليس بالضرورة سريعًا وإنما تلقائيًّا فحسب. وهذا مثال آخر للأهمية القصوى لاعتماد الكيميائيين على إنجازات الفيزيائيين، الفيزيائي كلاوزيوس في هذه الحالة، لفهم السبب وراء «حدوث» تفاعل كيميائي ما دون الآخر، وهذا أمر أساسي لعلم الكيمياء ويقع في نطاق تخصص الكيمياء الفيزيائية، الذي يعد حلقة الوصل بين الفيزياء والكيمياء.